자연요법 연구소인 허발짐(Herbalzym)에서는 전통적인 방법으로는 치료가 어려운 각종 암(cancer)과 난치성질환의 치료에 과학적 연구결과를 기초하여 개발된 천연물 및 생약 효소제를 사용하는 치료법을 연구.발전시켜왔습니다. 허발짐(Herbalzym) 요법은 지난 10여년간의 임상실험 및 말기환자의 치료를 통해 탁월한 치료효과를 계속 반복하여 입증하고 있습니다.
암세포는 정상세포조직과는 달리 더 많은 혈당(glucose)을 받아들이고, 유산소 환경에서도 혈당이 불완전하게 연소되는 당분해과정(glycolysis)을 선호하는 암 유발 대사작용(pro-oncogenic metabolism)으로 전환되며, 이를 워버그 효과(Warburg effect)라고 합니다.
대부분의 암세포에서는 당분해과정(워버그 효과)의 증가가 나타나며, 이러한 ATP(에너지원) 생산을 위한 대사적 경로를 암세포는 주요 에너지 공급원으로 이용합니다. 다수의 연구보고에서 암의 발달과정에 나타나는 여러 대사적 전환을 유도하는 가능한 기전들을 제시합니다. 이들 기전 중에는 미토콘드리아 결함과 기능이상, 종양의 저산소 미세환경 적응, 암유발성 신호경로 및 대사성 효소의 비정상적 발현이 포함됩니다.
당분해작용 전환스위치(glycolytic switch)는 대부분 고형암의 공격성 의제에서 특별한 위치를 점하고 있습니다. 이같은 당분해 대사과정으로의 전환은 암종양의 더욱 공격적인 새로운 혈관생성, 그리고 전이성 표현형으로 발달에 선행됩니다. 또한 당분해과정은 종양의 증식, 대사질환성 암, 그리고 대사작용과 혈관신생, 전이(metastasis) 간에 제시되는 필수적인 상호교신을 통해 널리 영향을 미칩니다.
암 특이적 치료법의 발달이 극히 제한적인 것은 대부분의 건강한 세포와 암세포가 모두 공통된 신호경로들에 의존하기 때문입니다. 중요하게도, 당분해과정의 억제는 효과적으로 …
암세포는 지속적으로 변화화는 미세환경 속에서 빠르게 증식하는 암의 대사적 수요를 총족시켜야만 합니다. 암의 대사작용은 정상세포의 대사작용에 비해 약 8배나 많으며, 신체는 이런 암세포에 영양분을 공급하기 위해 끊임없이 과로를 해야만 합니다. 대부분 고형암 내의 저산소 부위의 암세포와 유산소 상태인 신체 대부분의 정상세포 사이에는 당 대사작용(sugar metabolism)에서 근본적인 차이가 있습니다.
당 (또는 혈당)은 세포 속으로 들어가 ATP라고 하는 유용한 에너지원으로 전환됩니다. 이러한 당 대사의 또 다른 산물로 젖산(lactate)이 생성되고 특별한 운반체에 의해 세포 밖으로 분비됩니다. 혈당은 여러 단계에 걸친 일련의 효소촉매 생화학반응과정인 당분해작용(glycolysis)에 의해 대사되고, 피루브산(pyruvate)이 만들어집니다. 정상세포는 세포의 에너지 수요에 맞는 ATP를 생산하기 위해 많은 피루브산이 미토콘드리아로 들어가 구연산회로(TCA cycle)에서 산화됩니다.
그러나, 대부분 암세포는 미토콘드리아 대신 호기성 당분해과정(aerobic glycolysis)에 의존합니다. 노벨상 수상자인 오토 워버그(Otto Warburg)는 암세포가 에너지 생산을 위해 미토콘드리아에 크게 의존하지 않는 다는 것을 밝혔습니다. 대신에 암세포는 이용할 산소가 있음에도 혈당을 …
소위 수면호르몬(sleep hormone)으로 불리는 멜라토닌(melatonin)은 뇌의 중앙부위 위쪽에 존재하는 작은 콩만한 크기의 내분비기관인 송과선 (pineal gland)에서 분비되는 물질입니다. 송과체(pineal)는 낮에는 활성화되지 않습니다. 해가 지고 완전한 어둠이 내리면, 송과체가 스위치를 켜고 활발히 멜라토닌 생산을 시작하고, 혈액으로 분비합니다. 그러므로, 혈중 멜라토닌 수치는 야간에는 높고(80–120pg/ml), 주간에는 낮게(2–20pg/ml) 나타납니다.
사람이 빛이 드는 낮에는 깨어있고 어두운 밤에는 잠을 자는 양상은 자연적인 생활의 일부입니다. 다만 근래에야 과학자들이 수면과 각성(sleep and waking)의 교대주기, 그리고 이것이 일광 및 일몰 후 어두움과 어떻게 관련되었는지를 이해하기 시작한 것입니다.
멜라토닌은 잘 알려진 수면/각성주기(sleep/wake cycle) 및 일주기 생체리듬(circadian rhythms)의 제어조절 외에도, 면역조절, 혈구생성과정 (hematopoiesis), 그리고 항산화적 과정과 연관되어 있습니다.
멜라토닌은 체내에 존재하는 여러 일일주기(diurnal cycles)를 조절하는 호르몬입니다. 멜라토닌은 심장질환에서부터 당뇨병, 뼈의 건강 및 비만에 이르기 까지 모든 면에 유익한 효과가 있습니다. 그 중에서도 현재 최신연구에서 최고의 효과로 제시되는 것은 멜라토닌이 우리의 유전물질(genetic material)을 보호하고, …
AMPK (AMP-activated protein kinase)는 세포의 성장과 대사작용 조절에 핵심 역할을 하는 단백질(효소)입니다. AMPK는 암세포에서 에너지 대사작용 조절과, 이에 의한 암세포의 성장을 제어하는 중요한 조절인자로 대두되고 있습니다. AMPK는 세포의 에너지 상태를 저하(즉, 당 결핍) 시키는 호르몬과 사이토카인, 운동 및 스트레스에 의해 활성화되는 연료(에너지) 감지(세포의 연료 계기역할)을 하는 효소입니다
AMPK는 저산소상태(세포조직에 저하된 산소공급) 및 허혈(새포조직으로의 혈류 감소) 같이 세포내 AMP가 증가되거나 또는 ATP가 감소되어AMP:ATP 비율이 증가되는 스트레스적인 상태의 기간동안에 활성화됩니다. 스트레스 상태의 세포는 자신들의 생존을 위해 세포 대사작용을 동화작용(생합성)에서 이화작용(화합물의 분해) 상태로 전환합니다. 이것은 콜레스테롤, 지방산, 중성지방(triglycerides)의 합성을 억제하고, 세포주기(cell cycle)의 진행을 억제하지 않으며, 사멸기전인 세포자멸사(apoptosis)를 억제한다는 뜻입니다.
또한 AMPK는 흔히 사용되는 당뇨병 약물인 메트포민(metformin)에 의해 활성화 스위치가 켜집니다. 그러므로 AMPK 활성도의 저하는 인슐린저항성(insulin resistanc)과 관련되어 있으며, 인슐린저항성은 AMPK활성물질에 의해 개선될 수 있습니다. 따라서, 긴급한 에너지 수요에 대처하기 위한 AMPK의 활성화는 더 많은 …
프로락틴(prolactin)은 전립선에 영양효과(trophic effects)를 발휘하는 여러 폴리펩티드계(polypeptide) 인자의 하나입니다. 프로락틴은 현재 뇌하수체(pituitary)에서 유래된 호르몬의 하나로 보며, 그 생산(즉, 혈중농도)는 도파민(dopamine)에 의해 조절됩니다. 프로락틴은 성장호르몬과 밀접한 관계가 있습니다. 프로락틴은 뇌하수체 전엽의 소위 락토트로프(lactotrophs)라고 하는 프로락틴 분비세포에서 분비됩니다. 또한 프로락틴은 체내의 광범위한 다른 세포들에 의해 합성, 분비되며, 가장 주된 곳은 다양한 면역세포와 뇌, 그리고 임신시 자궁내막입니다.
여성에서 프로락틴의 주된 작용은 모유의 생산을 개시하고 지속시키는 것입니다. 이러한 작용은 유즙합성(lactogenesis)이라는 과정을 통해 일어나며, 호른몬 옥시토신(oxytocin)이 함께 작용합니다. 옥시토신은 뇌의 신경전달물질로 아직까지 깊이 연구되지는 않았습니다. 프로락틴은 남녀 모두에서 성호르몬(에스트로겐과 테스토스테론)의 수준을 저하시킵니다. 과도한 프로락틴과 그로 인한 에스트로겐 또는 테스토스테론의 저하는 성기능부전 및 월경이상(menstrual dysfunction)을 초래할 수 있습니다.
고프로락틴혈증(hyperprolactinemia: 혈중 과도한 프로락틴)의 남성은 전형적으로 성선기능저하증(낮은 혈중 테스토스테론)과 함께 성욕감퇴, 정자생산감소, 발기부전이 나타납니다. 항 정신병 약물(antipsychotic drugs)을 포함한 많은 약물이 발기부전의 원인이 될 수 있는 것은 과도한 프로락틴의 분비와도 …
 전립선암은 전립선 암줄기세포(prostate cancer stem cells)라고 부르는 드문 소집단 세포(subpopulation of cells)에서 유래합니다. 종양세포 중 극히 소수(1% 미만)를 차지하는 암줄기세포는 여러 암의 발달과 재발에 중요한 역할을 합니다. 이들 세포는 증식능력에 한계가 없는 각 세포의 분열로 자가복제(self-renewal)를 하는 줄기세포의 특징을 충분히 지녔습니다. 더욱이 암줄기세포는 죽지 않으며, 오히려 치료에 저항하고 전형적인 줄기세포 표식인자(표면항원)을 발현합니다. 잔존하는 이들 암줄기세포의 발생 기원은 아직 분명히 밝혀지지 않았습니다.
전립선암은 전립선 암줄기세포(prostate cancer stem cells)라고 부르는 드문 소집단 세포(subpopulation of cells)에서 유래합니다. 종양세포 중 극히 소수(1% 미만)를 차지하는 암줄기세포는 여러 암의 발달과 재발에 중요한 역할을 합니다. 이들 세포는 증식능력에 한계가 없는 각 세포의 분열로 자가복제(self-renewal)를 하는 줄기세포의 특징을 충분히 지녔습니다. 더욱이 암줄기세포는 죽지 않으며, 오히려 치료에 저항하고 전형적인 줄기세포 표식인자(표면항원)을 발현합니다. 잔존하는 이들 암줄기세포의 발생 기원은 아직 분명히 밝혀지지 않았습니다.
전통적인 전립선암 치료법은 주로 대부분의 분화된 종양세포(differentiated tumor cells)를 표적으로 삼지만, 그러나 암줄기세포는 손상을 받지 않고 건재합니다. 이것이 항암제내성을 지닌 새로운 암세포가 생기고 재발하는 이유입니다. 만일 환자에게서 관해(remission) 후 5년내에 암이 다시 나타나면 재발한 것으로 보아야 합니다. 따라서 암줄기세포를 성공적으로 제거하는 것은 암의 완치를 위한 효과적인 전략입니다. 암줄기세포를 죽이는 것은 가장 우선순위임이 분명합니다.
전립선암 줄기세포는 분화된 종양세포를 성장시키며, 또한 자가복제(self-renewal)를 하는 …
전립선의 정상적인 발달과 보존은 안드로겐수용체(androgen receptor, AR)를 통한 남성호르몬 안드로겐(androgen)의 역할에 의존합니다. 정상적인 전립선에서는 하루 1-2%의 세포가 사멸되고, 새로운 세포로 대체됩니다. 이는 안드로겐수용체에 의해 제어되는 정상적 전립선 기능의 일부입니다. 따라서 안드로겐수용체 기능의 자연적인 균형을 유지하는 것이 전립선건강의 핵심입니다.
안드로겐수용체는 인단백(phosphoprotein)으로 존재하며, 그 기능은 엄격히 통제되어 있습니다. 테스토스테론 또는 DHT(변형테스토스테론)이 존재할 때 안드로겐수용체는 복합체와 결합함으로써 열충격단백질(Hsp)과의 결합이 절단되고 활성화되며 표적위치의 DNA와 결합합니다. 이것은 리간드에 의해 활성화되는 전사인자(ligand-dependent transcription factor) 형태로, 유전자 발현을 증가 또는 감소시킬 수 있습니다.
안드로겐 의존성 전립선암(ADPC)과 비의존성 전립선암(AIPC)은 모두 자연치료제로 성공적인 치료가 가능합니다. 전립선암세포는 성장과 생존을 위해 주로 안드로겐 수용체에 의존하며, 이는 안드로겐 의존성 전립선암과 비의존성 전립선암 모두에 필수적입니다. 따라서 안드로겐 수용체의 전사작용을 억제할 수 있는 자연요법이 진행된 전립선암 치료에 필요합니다.
전립선암 치료에 사용되는 항호르몬요법(항안드로겐제재)는 아직 확실히 알려지지 않은 작용기전을 통해 안드로겐 수용체를 억제합니다. 항호르몬요법의 사용시 초기에는 어느 정도 종양억제효과를 …
이제 우리는 전립선특이항원(PSA)이 전립선 상피세포(epithelial cell)와 암세포 모두에서 생산되는 세린 프로테아제(serine protease)라는 효소의 일종이라는 것을 알고있습니다. 세린 프로테아제는 다른 단백질의 특정 펩티드 결합을 절단(분해)하는 효소군입니다. 그러므로 PSA는 피브로넥틴(fibronectin)과 라미닌(laminin) 같은 세포외 기질(세포의 구조적인 지지) 단백질을 분해하는 능력이 있습니다. 이러한 PSA의 작용이 전립선암의 증식과 침윤, 전이를 촉진하는 것으로 보입니다.
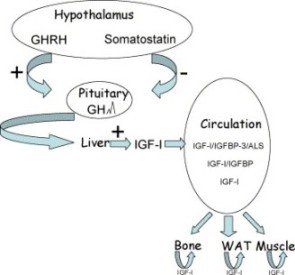 종양촉진 작용에 관련된 PSA의 또 다른 가능성은 인슐린유사성장인자-1 (IGF-1)과 결합된 단백질(BP-3)로부터 결합을 절단하여 유리(freeing)시키므로써 국소적 IGF-1 수준을 증가시키고, 종양을 증식시키는 것입니다. 성장호르몬(GH)의 촉진에 의해 주로 간에서 생성되는 IGF-1은 정상적인 생체내 작용과 암 같은 병적인 상태 양쪽의 제어에 중요합니다. 인체의 혈중 IGF-1 농도와 전립선암 발병위험의 증가 사이에는 정(+)의 상관관계가 존재합니다. IGF-1에 의한 그 수용체(IGF-1R)의 활성화는 정상세포와 전립선암세포에서 모두 세포분열 촉진효과와 세포사멸억제(anti-apoptosis) 효과를 나타냅니다.
종양촉진 작용에 관련된 PSA의 또 다른 가능성은 인슐린유사성장인자-1 (IGF-1)과 결합된 단백질(BP-3)로부터 결합을 절단하여 유리(freeing)시키므로써 국소적 IGF-1 수준을 증가시키고, 종양을 증식시키는 것입니다. 성장호르몬(GH)의 촉진에 의해 주로 간에서 생성되는 IGF-1은 정상적인 생체내 작용과 암 같은 병적인 상태 양쪽의 제어에 중요합니다. 인체의 혈중 IGF-1 농도와 전립선암 발병위험의 증가 사이에는 정(+)의 상관관계가 존재합니다. IGF-1에 의한 그 수용체(IGF-1R)의 활성화는 정상세포와 전립선암세포에서 모두 세포분열 촉진효과와 세포사멸억제(anti-apoptosis) 효과를 나타냅니다.
인슐린유사성장인자-1 수용체 (IGF-1R)는 세포 외부로부터의 자극을 세포내 반응경로에 전달하여 다양한 …
전술한 바와 같이 텔로머라제(telomerase)와 텔로미어(telomeres)는 항암자연요법에서 관심을 갖는 표적입니다. 종양은 정상적인 형태의 세포에 비해 비교적 길이가 짧은 텔로미어를 갖고 있습니다. 그러나 암세포에서는 텔로머라제(telomerase)라는 효소가 텔로미어의 길이를 유지시키므로, 암세포는 통제되지 않고 계속되는 분열과 다른 조직으로의 침윤이 가능합니다. 텔로머라제는 대부분의 암에서 활성화되며, 90% 이상의 전립선암에서 텔로머라제의 활성이 나타납니다. 텔로머라제 억제제는 암세포에서 텔로미어 길이가 짧아지도록 유도하며, 억제되지 않는 증식을 중단시킵니다. 밀크티슬(milk thistle)의 활성성분의 하나인 실리비닌(silibinin) 역시 텔로머라제의 활성도를 억제할 수 있습니다.
 그뿐만 아니라, 실리비닌은 또한 다중의 작용기전을 통해 전립선암 세포를 직접 죽일 수 있으며, 종양의 혈관신생 능력을 제한시킬 수 있습니다. 실리비닌은 또한 전립선암 세포의 침윤과 이동성(motility), 전이를 억제합니다. 실리비닌은 각각의 성상이 약간 다른 4가지의 동종형태(실리빈A, 실리빈B, 이소실리빈A, 이소실리빈B)가 있습니다. 암세포를 직접 죽이는 데 있어서는 동종형태(isoform)의 이소실리빈B (isosilybin B)가 가장 효과적입니다. 동물실험에서 이소실리빈B를 섭취한 …
그뿐만 아니라, 실리비닌은 또한 다중의 작용기전을 통해 전립선암 세포를 직접 죽일 수 있으며, 종양의 혈관신생 능력을 제한시킬 수 있습니다. 실리비닌은 또한 전립선암 세포의 침윤과 이동성(motility), 전이를 억제합니다. 실리비닌은 각각의 성상이 약간 다른 4가지의 동종형태(실리빈A, 실리빈B, 이소실리빈A, 이소실리빈B)가 있습니다. 암세포를 직접 죽이는 데 있어서는 동종형태(isoform)의 이소실리빈B (isosilybin B)가 가장 효과적입니다. 동물실험에서 이소실리빈B를 섭취한 …
아연은 남성호르몬 테스토스테론(production)의 생산에 필요하며, 전립선암의 진단과 진행을 측정하는 표지자인 PSA (전립선특이항원)의 효소적 활성을 억제합니다. PSA는 전립선 세포에서 만들어져 정액으로 분비되는 단백질입니다. PSA는 전립선 특이항원이지 전립선암 특이항원이 아닙니다. 그러므로 PSA 수치의 상승은 전립선암 이외에도 전립선염이나 전립선비대증 같은 일련의 증상에서도 나타납니다.
PSA는 전립선암 세포의 증식과 전이, 침윤에서 역할을 합니다. PSA는 분자량이 약 33 kDa인 세린 프로테아제(serine protease)라는 효소의 일종입니다. 세린 프로테아제는 다른 단백질의 특정 펩티드 결합을 절단(분해)하는 효소군입니다. 포유동물에서 세린 프로테아제는 많은 중요한 기능을, 특히 소화와 혈액응고 및 보체계(complement system: 혈장에 있는 약 30여종의 단백질로 구성된 다기능 방어시스템)에서 기능을 수행합니다. PSA의 세린 프로테아제 작용은 전립선암의 침윤과 전이에 관련되어 있습니다.
PSA는 실제로 시메노젤린(semenogelin 1, 2)이라는 정액단백질(semen proteins)을 분해시키는 효소며, 그 결과로 액화(liquefaction)가 일어나고 정자에 활발한 운동성을 부여합니다. 전립선은 신경을 포함한 주위 연부조직이 결합된 …