붉은색 육류와 가공육의 섭취는 선진국에서 주요 사망원인의 하나인 대장암 발병의 증가와 관련되어 있습니다. 과학자들은 붉은색 육류섭취와 대장암 발병의 연관성에 대한 설명으로 몇 가지 의견을 제시합니다. 그 중 하나는 육류를 고온에서 구울때 생성되는 발암 화학물질인 HCA(헤테로사이클릭아민류)입니다. HCA가 그러한 역할을 할 수도 있겠지만, 그러나 고온으로 구운 닭고기에서도 역시 높은 수준의 HCA가 존재하므로 이것만으로는 완전한 설명이 될 수 없습니다. 어느 경우든 대장암에 관련된 우려는 닭고기가 아니라 붉은색 육류로 한정됩니다. 가공육의 경우는 첨가된 보존료가 대장암 위험을 높이는 것으로 여겨지며, 특히 보존료인 질산염(nitrates)은 체내에서 강력한 발암 물질의 하나인 니트로사민(nitrosamine)으로 변형될 수 있습니다.
임상적 또는 역학적 증거들은 육류에 존재하는 헴철(heme iron)이 대장암을 촉진시킨다는 가설을 뒷받침합니다. 혈액속의 적혈구를 이루는 헤모글로빈이 분해되면 철(Fe) 을 포함한 헴(heme)과 글로빈(globin)으로 분리됩니다. 헴철(heme iron)은 육류와 생선, 가금류에서 하나의 화학적 구조로 나타나지만 식물에서는 비헴철(nonheme iron)로 나타납니다. 헴철(heme iron)은 인체에 쉽게 흡수될 수 있으며, 육류, …
고농도의 글루타민을 경구투여하면 혈중에서 글루타민의 분해물인 글루타메이트(glutamate) 역시 다량 생성됩니다. 글루타메이트(glutamate)는 세포 대사(cellular metabolism)에서 핵심역할을 하며, 뇌에서는 가장 중요한 신경전달물질(neurotransmitter)로서 신경세포 사이에서 끈임없이 정보를 전달합니다. 글루타메이트는 특히 신경계에 풍부합니다. 신경전달물질 중에서 자동차의 가속기 역할로 비유되는 대표적인 흥분성 신경전달물질(excitatory neurotransmitters)은 글루타메이트(glutamate)와 인공감미료 아스파탐(aspartame)의 주 성분인 아스파르트산(aspartate)이며, 한편 브레이크처람 억제 역할을 하는 가장 주요한 억제성 신경전달물질(inhibitory neurotransmitters)은 GABA입니다. 흥분성과 억제성 신경전달물질간의 균형(balance)은 적절한 뇌기능의 수행에 필수적입니다. 신경세포에서 방출된 글루타메이트는 후-시냅스 뉴런(post-synaptic neuron)의 글루타메이트 수용체(glutamate receptors)에 결합하여 흥분성 경로에 반응하며, 이는 감각인지나 학습, 기억, 제어와 같은 기초적 과정에서 중요한 역할을 합니다. 알츠하이머 같은 신경 퇴화성 질환에서는 글루타메이트 수용체들이 과다 활성을 보이면 소위 이런 흥분성 독성(excito-toxicity)으로 인해 뇌에 손상이 생길 수 있습니다.
암환자(cancer patients) …
암세포(cancer cell)의 주요 특징은 빠른 세포증식에 요구되는 많은 영양소의 공급과 에너지생산, 그리고 세포분열 과정에서 요구되는 다양한 세포구성물질의 생합성 작용(biosynthetic activity)을 강화시키기 위해 세포의 대사작용(metabolic activity) 을 정상세포와는 다르게 근본적으로 변환시키는 것입니다. 글루타민(glutamine)은 체내에서 가장 풍부한 아미노산(단백질구성원)이며, 신체에서 근육조직은 아미노산의 주요 저장원입니다. 글루타민은 근육에 저장되는 아미노산의 60%를 차지합니다 (또한 근육 단백질 분자의 5~7% 정도를 구성하는 적은 양의 성분이지만, 이것은 근육세포와 섬유질이 분해되지 않고 제 형태를 유지하게 해주는 빌딩블록 역할을 합니다).
글루타민이 “조건부 필수(conditionally essential)” 영양소로 불리는 이유는 정상적인 상태에서는 필요로 하는 만큼 체내에서 합성할 수 있는(식품으로 보충하지 않아도 되는) 비필수(non-essential) 아미노산이지만, 그러나 중증 질환이나 부상의 경우는 체내합성만으로는 불충분하므로, 식품이나 보충제를 통해 추가적인 보충이 반드시 필요하기 때문입니다. 글루타민은 체내에서 글루타메이트(glutamate)와 암모니아(ammonia)가 글루타민합성효소(glutamine synthetase)에 반응하여 생성되며, 주로 골격근육(skeletal muscles)에서 이러한 합성과정이 이루어집니다.
글루타민(glutamine)은 적절한 항산화 상태(antioxidant status)의 유지를 비롯해 근육조직의 형성과 유지, 적절한 면역기능의 유지, …
전통적인 암치료법에서는 단지 암세포를 제거하는 것에 대해서 모든 초점을 맞추어 왔으며, 암 줄기세포(cancer stem cells)는 치료목표에서 상대적으로 소외되어 왔습니다. 일부의 암에서는 항암치료를 통해 암세포를 어느 정도 죽이는 효과를 일시적으로 거둘 수는 있겠지만 그러나 소수의 암줄기세포(cancer stem cells)는 항암이나 방사선 치료에도 죽지 않고 살아남아 잠복하며, 후에 다시 암세포 형태로 활발하게 증식하고 신체의 다른 부위로 전이되고 맙니다. 암줄기세포는 단 한 개가 살아남는다고 하더라도, 시간이 경과하면 후에 다시 더욱 공격적인 악성종양 형태로 완전하게 재발하게 됩니다. 그러므로 암 치료법이란 암세포들을 죽이는 목표 외에도 암 줄기세포가 다시 새로운 형태로 증식을 시작하여 더욱 심각한 문제를 일으키기 전에 완전하게 제거되도록 하는 것을 목표로 실행되어야만 합니다. 만일 암 줄기세포를 완전히 사멸시킨다면 암이 완전히 제거(완치)될 것입니다.
세포가 분열하고 노화되는 과정에서 유전자가 관여하는데 그것이 텔로미어(telomere)라는 염색체 끝 부분의 핵산서열로 세포가 분열 할 때마다 조금씩 길이가 줄어들게되며 세포분열의 한계점에서는 텔로미어가 다 없어지고 …
 파테놀리드(parthenolide)는 휘버휴(feverfew) 같은 약용식물의 세스퀴터펜 락톤(sesquiterpene lactones)에서 추출되는 성분입니다. 세스퀴터펜 락톤(sesquiterpene lactones)은 식물에서 유래된 성분으로 여러 식물의 오일에 함유되었으며, 전통적으로 항암, 항염증(항바이러스, 항진균) 효능을 지닌 것으로 알려졌습니다. 임상치료에 사용되는 세스퀴터펜 락톤(sesquiterpene lactones)은 아르테미시닌(artemisinin), 탑시가진(thapsigargin), 파테놀리드(parthenolide) 그리고 여러 합성 유도체(synthetic derivatives)들이 있습니다. 이들 성분들은 암 종양과 암 줄기세포의 특정 신호경로를 표적으로 하는 임상치료에서 선별 적용되고 있습니다.
파테놀리드(parthenolide)는 휘버휴(feverfew) 같은 약용식물의 세스퀴터펜 락톤(sesquiterpene lactones)에서 추출되는 성분입니다. 세스퀴터펜 락톤(sesquiterpene lactones)은 식물에서 유래된 성분으로 여러 식물의 오일에 함유되었으며, 전통적으로 항암, 항염증(항바이러스, 항진균) 효능을 지닌 것으로 알려졌습니다. 임상치료에 사용되는 세스퀴터펜 락톤(sesquiterpene lactones)은 아르테미시닌(artemisinin), 탑시가진(thapsigargin), 파테놀리드(parthenolide) 그리고 여러 합성 유도체(synthetic derivatives)들이 있습니다. 이들 성분들은 암 종양과 암 줄기세포의 특정 신호경로를 표적으로 하는 임상치료에서 선별 적용되고 있습니다.
파테놀리드(parthenolide)는 전통적으로 편두통(migraine)과 류마티스관절염의 치료에 수세기 동안 사용되었으며, 근래에는 실험에서 대장암, 췌장암, 간암, 백혈병, 담도암(cholangiocarcinoma) 같은 다양한 종류의 암세포의 증식 억제와 사멸(apoptosis)을 유도한다는 연구결과가 보고되기도 하였습니다. 또한 파테놀리드(parthenolide)는 내성이 생긴 암세포의 항암제에 대한 감수성을 높일 수 있으며, 동물실험에서는 피부암을 막아주는 작용을 하는 것으로 밝혀졌습니다. 이 외에도 연구보고는 파테놀리드(parthenolide)가 전사인자 NF-kB억제와 STAT-3의 조절, MAP키나제(kinase)의 활성억제, TRAIL이 매개하는 항사멸 단백질의 차단 유도, 미토콘드리아 기능이상, 활성산소종(ROS)의 증가 등의 작용으로 암세포의 …
암이 발생, 진행되고 약물에 대해 내성을 갖게 되는 데에는 종양유전자의 활성화와 종양억제 유전자의 불활성화로 요약할 수 있는 유전자 발현의 후생적 조절(epigenetic control)이 매우 중요한 역할을 합니다. 후생적 조절(epigenetic control)이란 DNA 염기서열이 변하지 않는 상태에서 이루어지는 유전자 발현의 조절을 일컬으며, 몇 가지 화학적변형을 통해 DNA가 팩킹(packing: DNA는 당과 단백질이 단추역할처럼 후크를 만들어 팩킹되어 안전하게 보존되어 있다가 필요시 떼어내 사용) 되는 것을 바꾸는 스위치가 꺼지거나 켜지기 용이하도록 만드는 것입니다. 이러한 패턴의 변화가 자연적으로 활성화되는 것은 무엇보다도 개개인마다 처한 독특한 환경적 요인이나 스트레스, 식습관, 운동, 독성물질에 노출 등에 의해 영향을 받습니다. 유전자발현의 후생적 리모델링(epigenetic remodeling) 동안 나타나는 후생적 변화는 크게 3가지 형태로 구분됩니다.
DNA의 메틸화(methylation): DNA 염기에 메틸기(CH3-)가 붙는 메틸화(methylation)가 종양발생 동안에 이상조절될 수 있으며, 종양억제 유전자를 비롯한 다른 유전자들이 불활성화 됩니다.
히스톤 변형(Histone modifications): 히스톤(histone)은 핵 내에서 DNA와 결합하여 그 작용을 나타내는 주요 단백질로 …
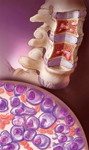 다발성 골수종(multiple myeloma)은 백혈구의 일종인 형질세포(plasma cell)가 무한 생성되어 발생하는 골수(myeloma)의 암입니다. 정상인의 경우는 골수에 형질세포(plasma cell)가 5% 미만의 분포로 면역글로블린(Immunoglobulin: Ig)이라는 항체를 만듭니다. 그러나 다발성골수종(multiple myeloma)에서는 형질세포가 걷잡을 수 없이 증식하여 단일 형태의 면역글로불린(Ig)을 과도하게 생성하므로, 다른 형태의 면역글로불린(Ig) 양이 위험할 정도로 낮게 떨어져서 환자가 감염에 노출됩니다. 암성 형질세포(malignant plasma cell)는 거의 모든 뼈로 전이되어 비정상적인 형질세포로 채워지고 정상적인 뼈가 녹아 내립니다. 그 결과 여러 군데 뼈에 구멍이 나는 증세가 나타나기 때문에 다발성(multiple)이라는 이름이 붙었고, 뼈의 통증과 골다공증, 골절, 그리고 녹아내린 뼈로 인해 혈중 칼슘치가 증가하는 고칼슘혈증(hypercalcemia)이 생기고 콩팥에 손상을 줍니다. 또한 혈액을 만드는 골수를 비정상적인 형질세포가 차지하고 있어 적혈구, 백혈구, 그리고 혈소판이 적게 만들어져 빈혈, 감염, 그리고 출혈 등이 야기됩니다.
다발성 골수종(multiple myeloma)은 백혈구의 일종인 형질세포(plasma cell)가 무한 생성되어 발생하는 골수(myeloma)의 암입니다. 정상인의 경우는 골수에 형질세포(plasma cell)가 5% 미만의 분포로 면역글로블린(Immunoglobulin: Ig)이라는 항체를 만듭니다. 그러나 다발성골수종(multiple myeloma)에서는 형질세포가 걷잡을 수 없이 증식하여 단일 형태의 면역글로불린(Ig)을 과도하게 생성하므로, 다른 형태의 면역글로불린(Ig) 양이 위험할 정도로 낮게 떨어져서 환자가 감염에 노출됩니다. 암성 형질세포(malignant plasma cell)는 거의 모든 뼈로 전이되어 비정상적인 형질세포로 채워지고 정상적인 뼈가 녹아 내립니다. 그 결과 여러 군데 뼈에 구멍이 나는 증세가 나타나기 때문에 다발성(multiple)이라는 이름이 붙었고, 뼈의 통증과 골다공증, 골절, 그리고 녹아내린 뼈로 인해 혈중 칼슘치가 증가하는 고칼슘혈증(hypercalcemia)이 생기고 콩팥에 손상을 줍니다. 또한 혈액을 만드는 골수를 비정상적인 형질세포가 차지하고 있어 적혈구, 백혈구, 그리고 혈소판이 적게 만들어져 빈혈, 감염, 그리고 출혈 등이 야기됩니다.
Multiple myeloma: diagnosis and treatment.
Treatment of …
다음을 생각해 보시기 바랍니다. 가장 큰 문제는 현재 항암치료 약물에 대한 암세포의 내성을 차단할 수단이 전혀 마련되어 있지 않다는 것입니다. 우리는 항암치료 약물 자체를 반대하는 것이 아닙니다. 우리는 거대제약회사의 배를 불리는 것 외에는 거의 아무런 효능이 없는 새로운 독성항암약물을 폭발적으로 사용하는 것에 반대하는 것입니다. 병원에서는 항암제에 내성을 나타내기 이전에 암세포를 죽여야만 하므로, 처음부터 많은 양의 독성약물을 투여하지만, 이로 인해 정상세포마저 파괴되어 신체 기능이 크게 손상되고, …
암 유전자 RAS와 RhoA는 이상적인 동반자로 작용하며, RhoA가 계획된 세포사멸(apoptosis)을 막아내어 암세포가 죽지않고 살아남는 동안, RAS는 암세포의 성장을 강화시킵니다. 양쪽 모두 자연치료제 조르반(Zorvan), 씨놀짐(SinnolZym), 지놀짐(GinolZym), 루테올린(luteolin)을 비롯해 스태틴(statin)계 약물과 좀메타(Zometa)와 액토넬(Actonel)같은 비스포스포네이트(nitrogen bisphosphonates)계 약물을 통해 억제가 가능하다고 앞에서 설명드렸습니다. 아래 연구보고는 비스포스포네이트(nitrogen bisphosphonates) 계 약물의 항암작용에대해 주로 다루었으며, 콜레스테롤 합성경로에서 스태틴(statin)계의 약물과 비스포스포네이트(nitrogen bisphosphonates) 계 약물의 작용에 대해 잘 설명합니다. 다음 연구보고는 스태틴(statin)계 약물이 암 발병을 줄여주는 효능에 대한 좋은 내용입니다. 여기에서는 스태틴(statin)계 약물이 어떤 종류의 암이든 전체적으로 28 %를 줄여주는 결과를 보여줍니다. 이것은 매우 포괄적인 연구지만, 특정 스태틴(statin)계 약물과 차이는 없습니다. 또 다른 연구에서는 스태틴(statin)계 약물을 적정량을 사용하여 혈관을 암세포 속으로 성장하도록 유인하는 VEGF (혈관내피세포성장인자)의 분비 억제를 통해 암세포성장을 억제시키는 것이 매우 중요한 요인임을 보여줍니다. 낮은 용량의 스태틴(statin)계 약물은 혈관신생(angiogenesis)을 촉진하지만 고용량을 사용시에는 GGPP (geranylgeranyl pyrophosphate, 게라닐게라닐파이로인산)의 작용에 의해 반대로 혈관신생을 억제(anti-angiogenesis)합니다. Statins have biphasic effects on angiogenesis. Cerivastatin, an inhibitor of 3-hydroxy-3-methylglutaryl coenzyme a reductase, inhibits endothelial cell proliferation induced by angiogenic factors …
암치료의 핵심목표: 콜레스테롤(cholesterol) 대사의 조절 (5)
병원에서 항암치료(chemotherapy)를 받다 보면 대부분 암세포는 얼마 후 내성(drug resistance)을 갖게 됩니다. 이 때 의사들은 항암제 종류를 바꾸어 새로이 시도를 해보지만 바뀐 항암제 역시 효과가 없고 증세가 오히려 더 악화되는 경우가 거의 대부분입니다. 마지막으로 의사들은 새로이 개발중인 신약의 사용을 권하며 임상실험을 하기도 하지만, 역시 효과 없이 한 가닥 희망마저 사라지게 됩니다. 이 단계에 이르면 의사는 집에서 생을 마감하도록 환자를 돌려보냅니다. 물론 이런 일이 절대로 일어나서는 안될 것입니다.암치료의 핵심목표: 콜레스테롤(cholesterol) 대사의 조절 (4)
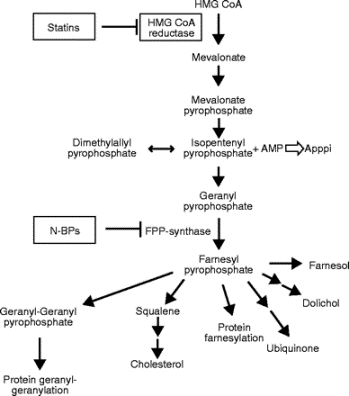 좌측의 도표를 보면 콜레스테롤(Cholesterol) 등을 생합성하는 메발로네이트 경로(mevalonate pathway)에서 스태틴(statins)계 약물은 HMG-CoA 환원효소를, 비스포스포네이트(nitrogen bisphosphonates: N-BPs)는 뼈를 분해하는 역할을 하는 파골세포 기능에 중요한 효소인 FPP (Farnesyl pyrophosphate) 합성효소(synthase)를 강력하게 억제하는 것을 알 수 있습니다. 골다공증 치료제인 비스포스포네이트(bisphosphonates)는 여러 경로에 작용하여 골흡수를 억제하는 작용이 강하므로 특히 유방암, 전립선암, 폐암을 비롯해 뼈로 전이가 …
좌측의 도표를 보면 콜레스테롤(Cholesterol) 등을 생합성하는 메발로네이트 경로(mevalonate pathway)에서 스태틴(statins)계 약물은 HMG-CoA 환원효소를, 비스포스포네이트(nitrogen bisphosphonates: N-BPs)는 뼈를 분해하는 역할을 하는 파골세포 기능에 중요한 효소인 FPP (Farnesyl pyrophosphate) 합성효소(synthase)를 강력하게 억제하는 것을 알 수 있습니다. 골다공증 치료제인 비스포스포네이트(bisphosphonates)는 여러 경로에 작용하여 골흡수를 억제하는 작용이 강하므로 특히 유방암, 전립선암, 폐암을 비롯해 뼈로 전이가 …
암치료의 핵심목표: 콜레스테롤(cholesterol) 대사의 조절 (3)
« Older Entries Recent Entries »