소화기와 장 기능, 면역기능, 신체 밸런스를 자연 회복시키는 장-친환경 (Gut Ecology) 페이스트 “플락스짐”
만일 제가 여러분에게, 맛과 질이 뛰어난 단 한 가지의 유일한 순 식물성 유기농 페이스트(paste)가 소화장애, 복부팽만, 가스, 만성변비, 설사, 과민성대장, 염증성 대장(궤양성대장염, 크론병), 위식도역류증, 장누수, 치질, 대장용종, 대장암 및 유방암, 난소암, 전립선암 같은 암, 만성 알레르기, 관절염, 각종 자가면역질환, 만성염증, 당뇨병, 고혈압, 심장질환, 간질환, 고지혈증, 면역력저하, 만성감염, 여드름, 습진, 아토피, 건선, 만성피로, 폐경증후군, 골다공증, 편두통, 우울증, 불안, 주의력결핍장애(충동성과 학습장애), 그리고 때로는 자폐증 같은 증상마저 예방 또는 치유를 돕고, 또한 허기와 고통없이, 금식을 하지 않고도 비만(과체중)을 쉽고 빠르게 줄이도록 도와준다고 말한다면, 약간 의아한 눈으로 바라보실 것입니다. 그러나 이것은 사실이며, 그 스토리는 이렇습니다.
소화기 건강: 모든 질환은 장에서 시작
장은 인체 건강의 중심에 있으며, 영양공급, 인체의 기능, 면역, 에너지, 체성분, 감정상태 및 기타 우리의 삶의 질 결정요인에 영향을 미치는 핵심요소입니다. 장은 모든 소화의 양상을 감독하는 약 1억개의 신경망으로 이루어진 장관신경계(ENS)에 의해 조절됩니다. 그리고 우리의 소화기계 내에 분포한 모든 신경세포(neuron)들은 미주신경(vagus nerves)을 경유해 뇌와 긴밀한 연락을 할 수 있게 합니다. 최근 연구보고는 장이 우리의 수 많은 정신적, 신체적 기능의 다른 영역에 연결, 접속되어 있어서 거의 “제2의 뇌”와 같다는 것을 보여줍니다.
그러나 다음의 몇 가지 이유로 인해 장 기능이 손상되는 경우가 흔합니다:
⦁ 식품 알레르기와 글루텐 불내증(gluten intolerance)
⦁ 항생제 및 기타 약물의 사용
⦁ 정제된 탄수화물과 설탕, 가공식품이 많은 식단
⦁ 발효성(fermentable) 식이섬유가 적은 식단
⦁ 음식물의 유독물질과 중금속
⦁ 만성 감염
⦁ 낮은 수준의 체내 만성염증
⦁ 만성 스트레스
⦁ 과도한 음주
⦁ 노화에 따른 신체조성의 변화
장의 기능성 장애는 사실상 거의 모든 질환과 연결될 수 있으며, 다음과 같은 여러 증상의 원인일 수 있습니다: 소화장애, 변비, 설사, 장누수, 치질, 음식물 과민증, 식도역류증, 염증성장질환, 면역력 저하, 만성감염, 만성피로, 우울증, 불안, 만성통증, 각종 자가면역질환, 알레르기, 관절염, 비만(과체중), 당뇨병, 심장질환, 간질환, 암, 여드름, 습진, 아토피, 피부병변 외 다수. 미국에서는 최소 7천만명 정도가 어떤 종류의 소화기질환(가슴앓이는 불포함)으로 고통 받고 있으며, 소화기 장애로 인한 비용은 전체 의료비지출의 거의 10%에 달합니다.
우리가 섭취한 음식물이 장 건강을 지켜주거나, 또는 깨뜨릴 수 있습니다.
장은 인체에서 스스로 가장 빠르게 수리, 복구되는 부위입니다. 건강한 장관 내벽은 상피 점막을 이루는 세포가 마치 벽돌로 쌓은 벽처럼 치밀하게 결합되어 있으며, 점막세포 사이에는 밀착연접(tight junctions)된 구조가 있습니다. 이 구조의 표면은 반투과성(semi-permeable)이므로, 적절히 소화된 영양소와 물이 체내로 유입되도록 허용하지만, 한편 유독물질이나 항원(antigen)의 유입은 차단합니다. 유독물질이나 항원(antigen)에 반복적으로 노출이 되면 이는 식품 알레르기, 식품 불내증 및(또는) 염증성 장질환을 일으키는 원인이 됩니다. 이것은 흔히 장내미생물군의 불균형, 칸디다균의 과증식, 장누수(leaky gut), 복통 및 면역기능의 손상과 함께 나타납니다.
장누수(leaky gut)는 흔히 다음과 같은 증상으로 진행됩니다: 알레르기, 천식, 제1형 당뇨병, 정신질환(우울증과 정신분열증 포함), 자폐증, 여드름 및 주사(rosacea), 습진 같은 피부염증.
장내미생물군(gut microbiome)의 중요성은 더 말할 나위가 없습니다. 약 5백만개의 유전자 정보를 분석하는1000 종류에 이르는 박테리아가 서식하는 장내미생물군(이들의 유전정보 포함)은 우리의 “잊혀진 기관 (forgotten organ)”이라고도 합니다. 장 박테리아는 신체에서 소화시킬 수 없는 음식물을 분해하고, 중요한 영양성분들을 만들며, 면역시스템의 항체생성을 조절하고, 뇌에 정보를 전달하고, 대사작용의 조절을 도와주며, 그리고 기본적인 생리적 과정과 아울러 학습, 기억, 감정상태 같은 정신적 과정의 조절에서 뇌가 이용하는 수 백 가지의 신경화학물질을 만듭니다. 장은 특히 만성적인 스트레스(심지어 급성 역시)에 취약하며, 스트레스로 인해 장 분비물, 장 연동운동, 장 점막투과성, 장 내벽의 기능, 장 민감도 및 장 점막의 혈류에 변화가 유발됨을 보여줍니다.
좋은 음식물은 탁월한 치료제
건강하고 균형잡힌 장내미생물군은 면역시스템을 강화시키고, 만성 염증의 수준을 낮춰줍니다. 건강하지 못한 장내미생물군은 거의 모든 질환과 연결되어 있습니다. 음식물과 장내미생물군 간의 관계는 호혜적 관계입니다: 우리가 먹는 음식물은 장내미생물군의 조성에 영향을 끼치며, 조성된 장내미생물군은 우리가 먹은 음식물을 소화, 흡수하는 방식에 영향을 끼칩니다.
이러한 요인들 뿐만 아니라, 부적절한 식단 역시 장기능 손상을 초래합니다. 장 세포조직 구축에 필요한 단백질, 지질, 지용성 영양소, 미네랄, 비타민이 결핍된 식단은 장기능이 깨지도록 만들 수 있습니다. 환경자극을 받거나 손상된 장은 인체 방어작용을 할 수 없으며, 그 대신 위험한 물질의 체내 유입을 허용합니다.
우리가 응급치료나 투약, 수술을 받는 것이 유용하고 때로는 필수적인 것이 사실이지만, 우리는 인체가 스스로를 치료하는 자가치료 메카니즘(self-healing mechanism)이란 것을 이해해야만 합니다. 만일 우리의 건강을 평안하게 높여주고 적절히 기능을 하도록 돕는 활성성분이 인체에 투입되면, 인체에 내재된 정보는 우리 몸을 치유할 준비와 의지가 있으며, 치유도 가능케 합니다. 인체가 적절히 기능하게 하고 인체를 수리하는데 요구되는 모든 활성성분이 함유된 좋은 음식물은 병을 예방하고 호전시키며, 치료마저 할 수 있는 탁월한 치료제입니다.
소화기 건강의 회복을 위해 해야 할 일들
우리 장의 건강한 박테리아는 발효성 식이섬유를 먹고 자라며, 그 대사물로 뷰트릭산(butyrate)이나 다른 단쇄지방산(short chain fatty acids)으로 바꿉니다. 우리 장 내벽 점막세포의 주 에너지원인 단쇄지방산은 장에서 식이섬유가 장박테리아에 의해 발효될 때 생산됩니다. 결과적으로, 이들 지방산은 식욕과 혈당을 조절하고, 염증을 제어하며, 면역기능을 향상시킵니다. 또한 뷰트릭산(butyrate)은 발암유전자의 발현을 차단하고, 항암화학요법 치료에 의해 자주 손상되는 장 내벽을 치유하도록 도와줍니다.
References:
The bowel and beyond: the enteric nervous system in neurological disorders. Rao M, Gershon MD. Nat Rev Gastroenterol Hepatol. 2016 Sep;13(9):517-28.
Gut-brain axis: how the microbiome influences anxiety and depression. Foster JA, McVey Neufeld KA. Trends Neurosci. 2013 May;36(5):305-12
The gut microbiome and diet in psychiatry: focus on depression. Dash S, Clarke G, Berk M, Jacka FN. Curr Opin Psychiatry. 2015 Jan;28(1):1-6.
The Effect of Microbiota and the Immune System on the Development and Organization of the Enteric Nervous System. Obata Y, Pachnis V. Gastroenterology. 2016 Nov;151(5):836-844.
Emerging roles of gut microbiota and the immune system in the development of the enteric nervous system. Kabouridis PS, Pachnis V. J Clin Invest. 2015 Mar 2;125(3):956-64.
Interactions between the microbiota and the immune system. Hooper LV, L ittman DR, Macpherson AJ. Science 2012;336:1268-73.
Chemical and pathogen-induced inflammation disrupt the murine intestinal microbiome. Borton MA, Sabag-Daigle A, Wu J, Solden LM, O’Banion BS, Daly RA, Wolfe RA, Gonzalez JF, Wysocki VH, Ahmer BMM, Wrighton KC. Microbiome. 2017 Apr 27;5(1):47
Epithelial barrier: an interface for the cross-communication between gut flora and immune system. Goto Y, Kiyono H. Immunol Rev. 2012 Jan;245(1):147-63.
Treatment Algorithm for Chronic Idiopathic Constipation and Constipation-Predominant Irritable Bowel Syndrome Derived from a Canadian National Survey and Needs Assessment on Choices of Therapeutic Agents. Tse Y, Armstrong D, Andrews CN, Bitton A, Bressler B, Marshall J, Liu LW. Can J Gastroenterol Hepatol. 2017;2017:8612189
Current and emerging treatments for irritable bowel syndrome with constipation and chronic idiopathic constipation: focus on prosecretory agents. Thomas RH, Luthin DR. Pharmacotherapy. 2015 Jun;35(6):613-30.
Functional Disorders: Slow-Transit Constipation. Tillou J, Poylin V. Clin Colon Rectal Surg. 2017 Feb;30(1):76-86.
The impact of ageing on the intestinal epithelial barrier and immune system. Man AL, Gicheva N, Nicoletti C. Cell Immunol. 2014 May-Jun;289(1-2):112-8.
Microbiome restoration diet improves digestion, cognition and physical and emotional wellbeing. Lawrence K, Hyde J. PLoS One. 2017 Jun 14;12(6):e0179017.
Probiotic food supplement reduces stress-induced gastrointestinal symptoms in volunteers: a double-blind, placebo-controlled, randomized trial. Diop L, Guillou S, Durand H. Nutr Res. 2008 Jan;28(1):1-5.
Towards an Integrative Understanding of Diet-Host-Gut Microbiome Interactions. Read MN, Holmes AJ. Front Immunol. 2017 May 8;8:538.
Neuroendocrine Dysregulation in Irritable Bowel Syndrome Patients: A Pilot Study. Stasi C, Bellini M, Gambaccini D, Duranti E, de Bortoli N, Fani B, Albano E, Russo S, Sudano I, Laffi G, Taddei S, Marchi S, Bruno RM. J Neurogastroenterol Motil. 2017 Apr 26.
Regulation of the serotonin transporter in the pathogenesis of irritable bowel syndrome. Jin DC, Cao HL, Xu MQ, Wang SN, Wang YM, Yan F, Wang BM. World J Gastroenterol. 2016 Sep 28;22(36):8137-48
Gastrointestinal disorders associated with migraine: A comprehensive review. Cámara-Lemarroy CR, Rodriguez-Gutierrez R, Monreal-Robles R, Marfil-Rivera A. World J Gastroenterol. 2016 Sep 28;22(36):8149-60.
Functional relevance of intestinal epithelial cells in inflammatory bowel disease. Okamoto R, Watanabe M. Nihon Rinsho Meneki Gakkai Kaishi. 2016;39(6):522-527.
Alcohol, Intestinal Bacterial Growth, Intestinal Permeability to Endotoxin, and Medical Consequences: Summary of a Symposium Vishnudutt Purohit, J. Christian Bode, Christiane Bode, David A. Brenner, Mashkoor A. Choudhry, Frank Hamilton, Y. James Kang, Ali Keshavarzian, Radhakrishna Rao, R. Balfour Sartor, Christine Swanson, Jerrold R. Turner. Alcohol. 2008 Aug; 42(5): 349–361.
Diet and microbiota in inflammatory bowel disease: The gut in disharmony. Rapozo DC, Bernardazzi C, de Souza HS. World J Gastroenterol. 2017 Mar 28;23(12):2124-2140.
Is intestinal inflammation linking dysbiosis to gut barrier dysfunction during liver disease? Brandl K, Schnabl B. Expert Rev Gastroenterol Hepatol. 2015;9(8):1069-76.
Diet, microorganisms and their metabolites, and colon cancer. O’Keefe SJ. Nat Rev Gastroenterol Hepatol. 2016 Dec;13(12):691-706.
Gastrointestinal microbiome and breast cancer: correlations, mechanisms and potential clinical implications. Yang J, Tan Q, Fu Q, Zhou Y, Hu Y, Tang S, Zhou Y, Zhang J, Qiu J, Lv Q. Breast Cancer. 2017 Mar;24(2):220-228
Interactions between host genetics and gut microbiome in diabetes and metabolic syndrome. Ussar S, Fujisaka S, Kahn CR. Mol Metab. 2016 Jul 18;5(9):795-803.
From the gastrointestinal tract (GIT) to the kidneys: live bacterial cultures (probiotics) mediating reductions of uremic toxin levels via free radical signaling. Vitetta L, Linnane AW, Gobe GC. Toxins (Basel). 2013 Nov 7;5(11):2042-57.
Can probiotics modulate human disease by impacting intestinal barrier function? Bron PA, Kleerebezem M, Brummer RJ, Cani PD, Mercenier A, MacDonald TT, Garcia-Ródenas CL, Wells JM. Br J Nutr. 2017 Jan;117(1):93-107.
Ecological and evolutionary forces shaping microbial diversity in the human intestine. Ley RE, Peterson DA, Gordon JI. Cell. 2006 Feb 24;124(4):837-48.
Gut Microbiota Modulation and Its Relationship with Obesity Using Prebiotic Fibers and Probiotics: A Review Dinesh K. Dahiya, Renuka, Monica Puniya, Umesh K. Shandilya, Tejpal Dhewa, Nikhil Kumar, Sanjeev Kumar, Anil K. Puniya, Pratyoosh Shukla. Front Microbiol. 2017; 8: 563.
Probiotics, prebiotics and synbiotics- a review. Pandey KR, Naik SR, Vakil BV. J Food Sci Technol. 2015 Dec;52(12):7577-87.
New approaches for bacteriotherapy: prebiotics, new-generation probiotics, and synbiotics. Patel R, DuPont HL. Clin Infect Dis. 2015 May 15;60 Suppl 2:S108-21.
Therapeutic Application of Synbiotics, a Fusion of Probiotics and Prebiotics, and Biogenics as a New Concept for Oral Candida Infections: A Mini Review. Ohshima T, Kojima Y, Seneviratne CJ, Maeda N. Front Microbiol. 2016 Jan 25;7:10.
Microbiome in atopic dermatitis. Wollina U. Clin Cosmet Investig Dermatol. 2017 Feb 22;10:51-56.
Metabolism of the lignan macromolecule into enterolignans in the gastrointestinal lumen as determined in the simulator of the human intestinal microbial ecosystem. Eeckhaut E, Struijs K, Possemiers S, Vincken JP, Keukeleire DD, Verstraete W. J Agric Food Chem. 2008 Jun 25;56(12):4806-12
Ruminal Prevotella spp. may play an important role in the conversion of plant lignans into human health beneficial antioxidants. Schogor AL, Huws SA, Santos GT, Scollan ND, Hauck BD, Winters AL, Kim EJ, Petit HV. PLoS One. 2014 Apr 7;9(4):e87949.
Health effects with consumption of the flax lignan secoisolariciresinol diglucoside. Adolphe JL, Whiting SJ, Juurlink BH, Thorpe LU, Alcorn J. Br J Nutr. 2010 Apr;103(7):929-38.
Flaxseed and cardiovascular health. Prasad K. J Cardiovasc Pharmacol. 2009 Nov;54(5):369-77.
Dietary lignans: physiology and potential for cardiovascular disease risk reduction. Peterson J, Dwyer J, Adlercreutz H, Scalbert A, Jacques P, McCullough ML. Nutr Rev. 2010 Oct;68(10):571-603.
Flaxseed and Diabetes. Prasad K, Dhar A. Curr Pharm Des. 2016;22(2):141-4. Review.
Flaxseed modulates inflammatory and oxidative stress biomarkers in cystic fibrosis: a pilot study. Turowski JB, Pietrofesa RA, Lawson JA, Christofidou-Solomidou M, Hadjiliadis D. BMC Complement Altern Med. 2015 May 13;15:148
Flaxseed consumption may reduce blood pressure: a systematic review and meta-analysis of controlled trials. Khalesi S, Irwin C, Schubert M. J Nutr. 2015 Apr;145(4):758-65
The potential health effects of dietary phytoestrogens. Rietjens IMCM, Louisse J, Beekmann K. Br J Pharmacol. 2017 Jun;174(11):1263-1280
Enterolactone Suppresses Proliferation, Migration and Metastasis of MDA-MB-231 Breast Cancer Cells Through Inhibition of uPA Induced Plasmin Activation and MMPs-Mediated ECM Remodeling Mali AV, Joshi AA, Hegde MV, Kadam ShS. Asian Pac J Cancer Prev. 2017 Apr 1;18(4):905-915.
Enterolactone Reduces Telomerase Activity and The Level of Its Catalytic Subunit in Breast Cancer Cells. Ilbeigi D, Nourbakhsh M, Khaghani S, Einollahi N, Kheiripour N, Gholinejad Z, Alaee M, Saberian M. Cell J. 2017 Spring;19(Suppl 1):37-43.
Differential and directional estrogenic signaling pathways induced by enterolignans and their precursors. Zhu Y, Kawaguchi K, Kiyama R. PLoS One. 2017 Feb 2;12(2):e0171390
Dietary fat and fiber interactively modulate apoptosis and mitochondrial bioenergetic profiles in mouse colon in a site-specific manner. Fan YY, Vaz FM, Chapkin RS. Eur J Cancer Prev. 2017 Jul;26(4):301-308
Chemoprotective epigenetic mechanisms in a colorectal cancer model: Modulation by n-3 PUFA in combination with fermentable fiber. Triff K, Kim E, Chapkin RS. Curr Pharmacol Rep. 2015 Feb;1(1):11-20.
Prebiotics: why definitions matter. Hutkins RW, Krumbeck JA, Bindels LB, Cani PD, Fahey G Jr, Goh YJ, Hamaker B, Martens EC, Mills DA, Rastal RA, Vaughan E, Sanders ME. Curr Opin Biotechnol. 2016 Feb;37:1-7.
Effects of Prebiotics and Synbiotics on Functional Constipation. Yu T, Zheng YP, Tan JC, Xiong WJ, Wang Y, Lin L. Am J Med Sci. 2017 Mar;353(3):282-292. doi: 10.1016/j.amjms.2016.09.014
Dietary fibres modulate the composition and activity of butyrate-producing bacteria in the large intestine of suckling piglets. Mu C, Zhang L, He X, Smidt H, Zhu W. Antonie Van Leeuwenhoek. 2017 May;110(5):687-696
The Short-Chain Fatty Acid Sodium Butyrate Functions as a Regulator of the Skin Immune System. Schwarz A, Bruhs A, Schwarz T. J Invest Dermatol. 2017 Apr;137(4):855-864.
From Dietary Fiber to Host Physiology: Short-Chain Fatty Acids as Key Bacterial Metabolites. Koh A, De Vadder F, Kovatcheva-Datchary P, Bäckhed F. Cell. 2016 Jun 2;165(6):1332-1345.
Impact of Glycosidic Bond Configuration on Short Chain Fatty Acid Production from Model Fermentable Carbohydrates by the Human Gut Microbiota. Harris HC, Edwards CA, Morrison DJ. Nutrients. 2017 Jan 1;9(1). pii: E26.
Towards microbial fermentation metabolites as markers for health benefits of prebiotics. Verbeke KA, Boobis AR, Chiodini A, Edwards CA, Franck A, Kleerebezem M, Nauta A, Raes J, van Tol EA, Tuohy KM. Nutr Res Rev. 2015 Jun;28(1):42-66
In vitro bacterial fermentation of tropical fruit fibres. Vong MH, Stewart ML. Benef Microbes. 2013 Sep;4(3):291-5.
Mango Supplementation Modulates Gut Microbial Dysbiosis and Short-Chain Fatty Acid Production Independent of Body Weight Reduction in C57BL/6 Mice Fed a High-Fat Diet. Ojo B, El-Rassi GD, Payton ME, Perkins-Veazie P, Clarke S, Smith BJ, Lucas EA. J Nutr. 2016 Aug;146(8):1483-91.
Short-chain fatty acids in control of body weight and insulin sensitivity. Canfora EE, Jocken JW, Blaak EE. Nat Rev Endocrinol. 2015 Oct;11(10):577-91
Colonic infusions of short-chain fatty acid mixtures promote energy metabolism in overweight/obese men: a randomized crossover trial. Canfora EE, van der Beek CM, Jocken JWE, Goossens GH, Holst JJ, Olde Damink SWM, Lenaerts K, Dejong CHC, Blaak EE. Sci Rep. 2017 May 24;7(1):2360.
Control of appetite and energy intake by SCFA: what are the potential underlying mechanisms? Chambers ES, Morrison DJ, Frost G. Proc Nutr Soc. 2015 Aug;74(3):328-36
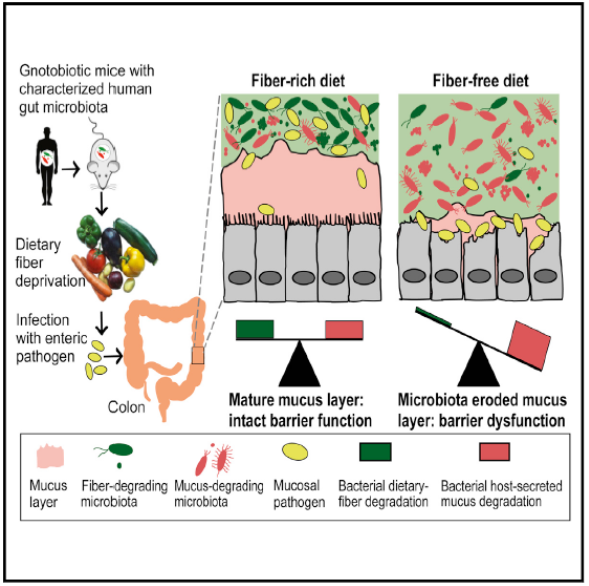
A Dietary Fiber-Deprived Gut Microbiota Degrades the Colonic Mucus Barrier and Enhances Pathogen Susceptibility. Desai MS, Seekatz AM, Koropatkin NM, Kamada N, Hickey CA, Wolter M, Pudlo NA, Kitamoto S, Terrapon N, Muller A, Young VB, Henrissat B, Wilmes P, Stappenbeck TS, Núñez G, Martens EC. Cell. 2016 Nov 17;167(5):1339-1353.e21