암세포는 지속적으로 변화화는 미세환경 속에서 빠르게 증식하는 암의 대사적 수요를 총족시켜야만 합니다. 암의 대사작용은 정상세포의 대사작용에 비해 약 8배나 많으며, 신체는 이런 암세포에 영양분을 공급하기 위해 끊임없이 과로를 해야만 합니다. 대부분 고형암 내의 저산소 부위의 암세포와 유산소 상태인 신체 대부분의 정상세포 사이에는 당 대사작용(sugar metabolism)에서 근본적인 차이가 있습니다.
당 (또는 혈당)은 세포 속으로 들어가 ATP라고 하는 유용한 에너지원으로 전환됩니다. 이러한 당 대사의 또 다른 산물로 젖산(lactate)이 생성되고 특별한 운반체에 의해 세포 밖으로 분비됩니다. 혈당은 여러 단계에 걸친 일련의 효소촉매 생화학반응과정인 당분해작용(glycolysis)에 의해 대사되고, 피루브산(pyruvate)이 만들어집니다. 정상세포는 세포의 에너지 수요에 맞는 ATP를 생산하기 위해 많은 피루브산이 미토콘드리아로 들어가 구연산회로(TCA cycle)에서 산화됩니다.
그러나, 대부분 암세포는 미토콘드리아 대신 호기성 당분해과정(aerobic glycolysis)에 의존합니다. 노벨상 수상자인 오토 워버그(Otto Warburg)는 암세포가 에너지 생산을 위해 미토콘드리아에 크게 의존하지 않는 다는 것을 밝혔습니다. 대신에 암세포는 이용할 산소가 있음에도 혈당을 젖산으로 직접 대사시켜 필요한 ATP의 50% 정도를 획득한다는 것입니다. 암세포의 이러한 현상을 “워버그효과 (Warburg effect)”라고 합니다. 이러한 대사적 적응은 암세포의 빠른 증식을 지원하려는 것입니다.
암세포는 2차적 연료 공급원으로 글루타민(glutamine)을 자주 사용하며, 글루타민은 미토콘드리아로 들어가서, 구연산회로(TCA cycle)의 중간산물로 채워져 사용될 수 있으며, 또는 말릭 효소(malic enzyme)의 작용을 통해 더 많은 피루브산(pyruvate) 생성에 이용될 수도 있습니다. 이를 글루타민분해과정(glutaminolysis)이라고 부릅니다.
암유발 전사인자인 c-MYC는 암세포의 성장과 증식에 요구되는 연료공급을 위해 글루타미나제(glutaminase)라는 효소를 상향조절하여 글루타민의 분해대사를 촉진합니다. 일반적으로, c-MYC단독으로는 암의 원인이 아닙니다. 그러나, c-MYC는 다양한 세포의 과도한 증식(hyperproliferation)을 촉진합니다. 모든 암과 백혈병의 80%에서 c-MYC의 과도한 활성이 나타납니다. 글루타민은 효소 글루타미나제에 의해 글루타메이트(glutamate)로 전환되며, 다시 구연산회로(TCA cycle)의 핵심 대사물인 알파-케토글루타레이트(α-ketoglutarate)로 대사됩니다. 잘 알려지지 않았지만, 글루타메이트는 또한 프롤린(proline)으로 전환될 수 있습니다 (프롤린과 대사작용의 연관성은 향후 풀어야할 숙제입니다)
이러한 대사적 변화는 (HIF-1α와 다른 암유전자들에 의해 유도된) 모든 신호경로 효소와 운반체의 과발현과 관련되었으며, 효소 헥소키나제(hexokinase) 및 효소 PFK1(phosphofructokinase type 1)과 다른 조절물질들의 발현과 관련되었습니다. 유전적변화와 후생유전적변화(epigenetic changes)에 더하여, 저산소상태의 종양세포의 세포 대사작용의 변형은 주로 HIF-1(저산소유도인자-1) 때문입니다. 이것은 암세포의 당분해작용(glycolysis) 억제물질 사용이 암 치료법의 하나로 개발될 수 있다는 효용성을 자연적으로 보여줍니다.
Cancer as a metabolic disease.
Understanding the Warburg effect: the metabolic requirements of cell proliferation.
Mitochondrial metabolism and ROS generation are essential for Kras-mediated tumorigenicity.
The proline regulatory axis and cancer.
Waves of gene regulation suppress and then restore oxidative phosphorylation in cancer cells.
Hypoxia and energetic tumour metabolism.
왕성한 증식을 하는 암세포는 새로운 생체의 생성을 위해 과량의 핵산과 지질(lipid) 및 아미노산의 생산이 필요합니다. 당화(glycosylation)는 당(다당류 또는 올리고당류)이 단백질, 지질, 또는 다른 유기물에 부가되는 것입니다 (당분해 glycolysis와 혼동하지 마시기 바랍니다). 암은 당단백질(glycoproteins)과 당지질(glycolipids)에서 당화(glycosylation)의 변형과 관련되어 있습니다.
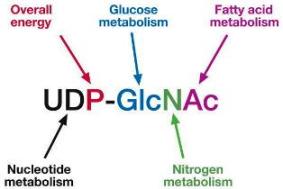 최신 연구보고는 종양세포는 주변환경에 반응하여 단백질에 당이 부가(adding)되는 당화(glycosylation)를 변형시킨다는 것을 밝혔습니다. 이것은 궁극적으로 악성세포들의 생존을 도와줍니다. 그리고 연구팀이 생쥐에게서 특정 단백질에 GlcNAc (“글릭낙”이라 부르는 특수한 당)이 부가되는 것을 차단했더니 종양세포의 성장이 저해되었습니다.
최신 연구보고는 종양세포는 주변환경에 반응하여 단백질에 당이 부가(adding)되는 당화(glycosylation)를 변형시킨다는 것을 밝혔습니다. 이것은 궁극적으로 악성세포들의 생존을 도와줍니다. 그리고 연구팀이 생쥐에게서 특정 단백질에 GlcNAc (“글릭낙”이라 부르는 특수한 당)이 부가되는 것을 차단했더니 종양세포의 성장이 저해되었습니다.
연구팀은 GlcNAc이 효소 PFK1(phosphofructokinase1)에 붙게 되면 당 분해가 초기단계에서 억제되고, 다른 경로-종양 세포를 보호하는 물질뿐만 아니라 종양이 생장하는데 필요한 핵산을 만드는 경로-로 들어가는 전구물질이 생산되는 쪽으로 변화가 일어난다는 것을 발견했습니다. 따라서, GlcNAc로 인해서 종양세포는 거래(trade) 즉, 고 에너지 산물의 생산을 적게 하는 대신, 생장과 생존에 필요한 물질을 얻을 수 있게 되는 것입니다. 발견된 메커니즘의 특이점은 GlcNAc의 부가가 역동적이고 가역적이라는 점입니다. 이는 암 세포들이 그들이 처한 환경에 따라서 자신들의 물질대사를 더 신속하게 변화시킬 수 있게 합니다.
연구팀은 저산소 수준과 같은 종양과 관련된 상황에서 이 당화(glycosylation)- PFK1에 GlcNAc의 부가-가 증진된다는 것을 발견했습니다. 또한 PFK1의 당화가 영양분의 가용성에 민감하다는 것도 발견했습니다. 어떤 영양분이 결핍될 경우, 당화가 증가하여, 종양은 그들의 물질대사를 변화시킴으로써 영양분의 부족을 보상할 수 있었습니다.
연구팀이 사람의 유방과 폐 종양 조직을 분석한 결과, 대부분의 종양에서는 동일 환자의 정상조직에 비해서 GlcNAc에 관련된 당화가 2~4배 높다는 것을 발견했습니다. 그리고, 사람의 폐암세포가 주입된 생쥐를 대상으로 기존의 PFK1효소를 정상적인 PFK1과 더 이상 당화가 일어날 수 없는 돌연변이형 PFK1으로 대체시켰습니다. 돌연변이형 PFK1으로 대체된 생쥐는 종양생장의 감소를 보였는데, 이는 당화의 차단이 암성 생장을 저해시킨다는 것을 의미합니다.
이번 연구 결과는 암 퇴치를 위한 앞으로의 연구에 있어 적어도 두 가지 가능한 방안을 시사합니다. 그 하나는 PFK1이 당화되는 것을 막을 수 있는 성분을 개발하는 것인데, 이는 이번 연구에서의 돌연변이형 PFK1 효소의 경우와 유사합니다. 다른 하나는 PFK1을 활성화시켜서 당 분해가 정상적으로 유지되게 하여, 암 세포들이 악성적 증식에 유리하도록 그들의 물질대사를 바꾸지 못하게 하는 것입니다.
Altered glycosylation of proteins in cancer: what is the potential for new anti-tumour strategies.
Phosphofructokinase 1 glycosylation regulates cell growth and metabolism.
 이상 설명과 같이, PFK1은 EMP경로를 통한 당분해(glycolysis) 작용에 중추적역할을 합니다. 혈당이 당분해 경로로 위임되는 첫번째 반응은 PFK1 효소에 의해 촉매됩니다. PFK1의 활성은 AMP (adenosine 5’-monophosphate)와 ATP (adenosine 5’-triphosphate)의 비율, 그리고 시트레이트(citrate)에 의해 조절되는 것으로 알려졌지만, 그러나, 이 외에도 효소 PFK2/FBP2 (6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase)의 산물인 F2,6BP (fructose 2,6-bisphosphate)의 세포내 수준에 의해서도 역시 PFK1의 활성이 조절되는 것으로 알려졌습니다. 다른 작동체들(effectors) 중에서 시트레이트(citrate)는 PFK1 활성 억제에 중추적 역할을 하는 것으로 보고되었습니다. PFK1 활성은 여러 다른 세포의 대사작용을 비롯해 전신의 대사적 상태에 중요한 결과를 안겨줍니다. PFK1은 여러 알로스테릭 작동체들(allosteric effectors)과 결합합니다 (작동체와 결합하므로써 효소의 본래 형태가 변화하는 경우 이러한 효소를 알로스테릭 효소라고 합니다)
이상 설명과 같이, PFK1은 EMP경로를 통한 당분해(glycolysis) 작용에 중추적역할을 합니다. 혈당이 당분해 경로로 위임되는 첫번째 반응은 PFK1 효소에 의해 촉매됩니다. PFK1의 활성은 AMP (adenosine 5’-monophosphate)와 ATP (adenosine 5’-triphosphate)의 비율, 그리고 시트레이트(citrate)에 의해 조절되는 것으로 알려졌지만, 그러나, 이 외에도 효소 PFK2/FBP2 (6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase)의 산물인 F2,6BP (fructose 2,6-bisphosphate)의 세포내 수준에 의해서도 역시 PFK1의 활성이 조절되는 것으로 알려졌습니다. 다른 작동체들(effectors) 중에서 시트레이트(citrate)는 PFK1 활성 억제에 중추적 역할을 하는 것으로 보고되었습니다. PFK1 활성은 여러 다른 세포의 대사작용을 비롯해 전신의 대사적 상태에 중요한 결과를 안겨줍니다. PFK1은 여러 알로스테릭 작동체들(allosteric effectors)과 결합합니다 (작동체와 결합하므로써 효소의 본래 형태가 변화하는 경우 이러한 효소를 알로스테릭 효소라고 합니다)
Control of glycolysis through regulation of PFK1: old friends and recent additions.
Evolution of allosteric citrate binding sites on 6-phosphofructo-1-kinase.
Understanding the central role of citrate in the metabolism of cancer cells.
허발짐 식초(Herbalzym Vinegar)는 약용버섯, 생 검정꿀, 곷감, 그리고 제니스짐(GenisZym), 대황(Rhubarb)추출물, 시코닌(Shikonin)을 포함한 순수한 천연허브와 그 추출물로 만들어졌습니다. 이 식초요법의 목적은 암세포의 대사작용을 방해하여 암세포의 발달을 변경시키거나 혹은 저해하는 것입니다.
 허발짐 식초는 암세포의 당분해작용과 에너지공급을 차단하도록 돕는 여러 성분들의 풍부한 궁급원입니다. 이것은 단순한 “식이” 를 훨씬 능가한다는 것을 기억하시기 바랍니다; 이것은 암세포의 발달을 저해하기 위한 혈당감소 프로토콜(protocol)이며, 그러므로 암세포들을 굶기고, 죽도록 하는 것입니다. 허발짐식초(대사조절 포뮬라)를 사용한 임상치료가 완료되었으며, 매우 효과적이었습니다.
허발짐 식초는 암세포의 당분해작용과 에너지공급을 차단하도록 돕는 여러 성분들의 풍부한 궁급원입니다. 이것은 단순한 “식이” 를 훨씬 능가한다는 것을 기억하시기 바랍니다; 이것은 암세포의 발달을 저해하기 위한 혈당감소 프로토콜(protocol)이며, 그러므로 암세포들을 굶기고, 죽도록 하는 것입니다. 허발짐식초(대사조절 포뮬라)를 사용한 임상치료가 완료되었으며, 매우 효과적이었습니다.
허발짐 식초는 암세포의 에너지공급을 차단하는 PFK1의 활성을 강력히 조절하고, 항암치료의 효용을 일제히 증가시키면서 독성부작용은 감소시킨다는 것이 입증되었습니다. 또한 가장 중요한 단일 종양억제유전자로 여기는 P53의 활성을 증가시키면서, c-MYC의 발현은 억제하였습니다. 더 이상 바랄 것이 없을 것입니다.
허발짐 식초는 체내에서 아세트산(acetic acid)과 시트르산(citric acid, 구연산)의 생산을 모두 증가시키는 천연품목입니다. 또한 아세트산(acetic acid)과 시트르산(citric acid)은 당분해(glycolysis) 과정의 차단을 통해 암과 싸우도록 도와줍니다. 정상세포는 대부분의 일일 에너지 공급을 아세트산(acetic acid)과 시트르산(citric acid)에서 구하지만, 암세포는 대부분의 일일 에너지 공급을 당분해과정에서 구합니다. 허발짐 식초는 훌륭한 항암, 항백혈병 천연치료제입니다.