 슈퍼버그(superbugs)라고도 불리는 슈퍼 박테리아(super bacteria)는 대부분의 항생제를 투여해도 죽지않고 저항하는 박테리아들입니다. 사람의 치료 뿐만이 아니라 가축의 사육에도 더 많이 사용되는 항생제의 남용은 항생제에 대한 내성을 지닌 슈퍼 박테리아를 출현, 확산시킵니다. 미생물(microorganisms)은 취약한 생명체지만 자신들을 보호하기 위한 고유의 방어법을 지니고 있으며, 이를 돌연변이(mutation)라고 합니다. 페니실린(penicillin) 같은 항생제는 하나의 효소(enzyme)를 표적물질(target)로 하지만, 박테리아는 돌연변이(변종)을 만들어 냄으로써 이를 손쉽게 극복합니다. 새로운 형태의 슈퍼 박테리아의 출현, 또는 기존 박테리아의 돌연변이는 질병 전문가들에게는 큰 걱정거리입니다. 어떤 종류의 박테리아는 항생제 내성이 너무 심해져서 궁극적으로 치료가 불가능해질 수 있다는 우려가 나오고 있습니다.
슈퍼버그(superbugs)라고도 불리는 슈퍼 박테리아(super bacteria)는 대부분의 항생제를 투여해도 죽지않고 저항하는 박테리아들입니다. 사람의 치료 뿐만이 아니라 가축의 사육에도 더 많이 사용되는 항생제의 남용은 항생제에 대한 내성을 지닌 슈퍼 박테리아를 출현, 확산시킵니다. 미생물(microorganisms)은 취약한 생명체지만 자신들을 보호하기 위한 고유의 방어법을 지니고 있으며, 이를 돌연변이(mutation)라고 합니다. 페니실린(penicillin) 같은 항생제는 하나의 효소(enzyme)를 표적물질(target)로 하지만, 박테리아는 돌연변이(변종)을 만들어 냄으로써 이를 손쉽게 극복합니다. 새로운 형태의 슈퍼 박테리아의 출현, 또는 기존 박테리아의 돌연변이는 질병 전문가들에게는 큰 걱정거리입니다. 어떤 종류의 박테리아는 항생제 내성이 너무 심해져서 궁극적으로 치료가 불가능해질 수 있다는 우려가 나오고 있습니다.
슈퍼 박테리아의 감염 치료에 의사들이 전통적인 항생제를 처방하면, 이들 항생제는 박테리아 퇴치에 늘 실패하고 맙니다. 대신, 약물투여에도 불구하고 박테리아는 사실상 더욱 더 번성하고, 때로는 환자의 생명마저 잃게 됩니다. 내성을 지닌 박테리아를 퇴치하기 위해 의사들은 더욱 강력한 항생제로 바꿔 보지만, 그러나 어떤 슈퍼 박테리아들은 가장 강력한 항생제마저도 막아내고 번성하는 능력을 키우게 됩니다. 항생제 투여에서 살아남는 박테리아는 다른 항생제를 추가 투여해도 살아남는 유전자 구조를 지닌 신종 박테리아로 발전합니다. 그리하여 신종 박테리아가 생겨나고 다른 동물에게 옮겨 갈 수 있게 됩니다. 대부분 형태의 슈퍼 박테리아는 여러 항생제에 내성을 지니며, 장래에도 추가적인 내성을 키울 수 있습니다.
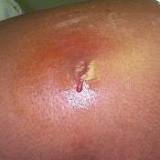 불행하게도, 박테리아가 염색체돌연변이(chromosomal mutations)와 새로운 유전자들의 결합, 그리고 때로는 다른 박테리아의 내성유전자를 받아 항생제에 내성을 지니게 되는 기전(mechanism)은 아직까지 확실히 밝혀지지 않았습니다. 몇몇 형태의 슈퍼 박테리아는 이미 문제들을 야기하며 존재합니다. 그 중 가장 잘 알려진 것이 메티실린(methicillin) 내성 황색포도상구균(MRSA) 박테리아며, 최근까지 병원 및 의료시설에서의 감염이 가장 주된 것으로 알려졌습니다. MRSA는 특정 항생제치료를 필요로 하는 심각한 내부, 외부 감염의 원인이 될 수 있습니다. 일반적으로 종기나 농양 또는 벌레에 물린 부위처럼 피부에 작고 붉은 병변이 생기는 것으로 증상이 시작합니다. 그리고 수술적 농양배액(드레인)을 해야하는 정도로 깊고 통증이 있는 농양으로 빠르게 바뀔 수 있습니다. 이 박테리아는 때로는 피부에 국한되어 존재합니다. 그러나 이 박테리아는 또한 체내로 침투하여 뼈와 관절, 수술부위 상처. 혈류, 심장판막과 폐를 위태롭게 하는 감염을 일으킬 수도 있으며, 결국에는 환자의 생명을 위태롭게 합니다. 최근 연구보고에 의하면 대부분의 MRSA의 경우 슈퍼 박테리아에는 효과가 없는 항생제들이 치료에 적용되고 있다고 합니다.
불행하게도, 박테리아가 염색체돌연변이(chromosomal mutations)와 새로운 유전자들의 결합, 그리고 때로는 다른 박테리아의 내성유전자를 받아 항생제에 내성을 지니게 되는 기전(mechanism)은 아직까지 확실히 밝혀지지 않았습니다. 몇몇 형태의 슈퍼 박테리아는 이미 문제들을 야기하며 존재합니다. 그 중 가장 잘 알려진 것이 메티실린(methicillin) 내성 황색포도상구균(MRSA) 박테리아며, 최근까지 병원 및 의료시설에서의 감염이 가장 주된 것으로 알려졌습니다. MRSA는 특정 항생제치료를 필요로 하는 심각한 내부, 외부 감염의 원인이 될 수 있습니다. 일반적으로 종기나 농양 또는 벌레에 물린 부위처럼 피부에 작고 붉은 병변이 생기는 것으로 증상이 시작합니다. 그리고 수술적 농양배액(드레인)을 해야하는 정도로 깊고 통증이 있는 농양으로 빠르게 바뀔 수 있습니다. 이 박테리아는 때로는 피부에 국한되어 존재합니다. 그러나 이 박테리아는 또한 체내로 침투하여 뼈와 관절, 수술부위 상처. 혈류, 심장판막과 폐를 위태롭게 하는 감염을 일으킬 수도 있으며, 결국에는 환자의 생명을 위태롭게 합니다. 최근 연구보고에 의하면 대부분의 MRSA의 경우 슈퍼 박테리아에는 효과가 없는 항생제들이 치료에 적용되고 있다고 합니다.
 클로스트리디움 디피실리(Clostridium difficile)라 불리는 박테리아는 단순 설사에부터 중증 설사, 장염, 위막성 대장염 등을 유발합니다. 항생제 투여로 인해 대장에 있는 많은 이로운 박테리아가 죽게 되면 클로스트리디움(C. difficile)이 과잉 번식할 수 있는 환경을 만듭니다. 클로스트리디움(C. difficile)이 과잉 번식하면 자극성 독성물질을 생산하여 장벽에 손상을 줌으로써 장염과 설사를 유발합니다. 그러나 어떤 사람들은 장에 클로스트리디움(C. difficile)이 있더라도 아무런 증상이 나타나지 않습니다. 병원에서 클로스트리디움(C. difficile) 감염이 MRSA감염보다도 더 많다는 것이 새로운 자료를 통해 밝혀졌습니다. 이로써 주로 병원이나 요양소에서 빠르게 확산되는 클로스트리디움(C. difficile)이 MRSA보다 더 공격적이라는 것을 확인할 수 있습니다. 항생제 내성을 지닌 클로스트리디움(C. difficile)은 병원에서 쉽게 확산될 수 있습니다. 사실은 항생제들이 이 박테리아의 감염위험을 실제로 높일 수 있습니다. 환자들의 감염치료를 위한 이들 항생제가 정상적인 장내 박테리아를 죽이게 되면, 장에서 클로스트리디움(C. difficile) 박테리아가 번식을 시작하기 때문입니다.
클로스트리디움 디피실리(Clostridium difficile)라 불리는 박테리아는 단순 설사에부터 중증 설사, 장염, 위막성 대장염 등을 유발합니다. 항생제 투여로 인해 대장에 있는 많은 이로운 박테리아가 죽게 되면 클로스트리디움(C. difficile)이 과잉 번식할 수 있는 환경을 만듭니다. 클로스트리디움(C. difficile)이 과잉 번식하면 자극성 독성물질을 생산하여 장벽에 손상을 줌으로써 장염과 설사를 유발합니다. 그러나 어떤 사람들은 장에 클로스트리디움(C. difficile)이 있더라도 아무런 증상이 나타나지 않습니다. 병원에서 클로스트리디움(C. difficile) 감염이 MRSA감염보다도 더 많다는 것이 새로운 자료를 통해 밝혀졌습니다. 이로써 주로 병원이나 요양소에서 빠르게 확산되는 클로스트리디움(C. difficile)이 MRSA보다 더 공격적이라는 것을 확인할 수 있습니다. 항생제 내성을 지닌 클로스트리디움(C. difficile)은 병원에서 쉽게 확산될 수 있습니다. 사실은 항생제들이 이 박테리아의 감염위험을 실제로 높일 수 있습니다. 환자들의 감염치료를 위한 이들 항생제가 정상적인 장내 박테리아를 죽이게 되면, 장에서 클로스트리디움(C. difficile) 박테리아가 번식을 시작하기 때문입니다.
MRSA가 그람양성(Gram-positive) 세균이기 때문에 그람음성(Gram- negative) 세균들에 대해서는 많이 거론되지 않지만, 그러나 그람음성 세균의 항생제내성 상황은 최소한 MRSA만큼이거나, 그보다 더 무서울 수도 있으며, 그 것은 그람음성균에 대한 치료제 신약개발이 그람양성균에 비해 훨씬 적기 때문입니다. 이들 두 범주의 세균은 세포벽 구조와 성분이 달라 항생제에 대한 반응도 다르므로 각각에 맞춤화된 항생제를 치료에 사용해야 합니다. (세균은 세포구조의 차이로 19세기 과학자 그람이 고안한 염색법을 통해 나타나는 색상반응에 따라 그람양성과 그람음성으로 구분합니다)
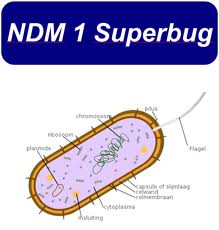 NDM-1(New Delhi metallo-beta-lactamase-1)이라는 효소는 박테리아가 광범위 베타-락탐계 항생제(beta-lactam antibiotics)에 내성을 갖도록 만듭니다. 항생제내성 박테리아 감염 치료에 사용되는 주된 버팀목인 카바페넴(carbapenem) 계열의 항생제도 이들에 속하며, NDM-1은 카바페넴(carbapenem)을 분해합니다. NDM-1은 2008년 인도계 스웨덴인으로부터 분리된 폐렴간균(Klebsiella pneumonia)에서 처음 검출되었습니다. 폐렴간균(Klebsiella pneumonia)은 폐렴, 혈류감염, 상처나 수술부위감염, 카테터 관련 요로감염 (catheter associated urinarytract infection)을 포함한 여러 다른 형태의 의료시설관련 감염을 일으킬 수 있습니다.
NDM-1(New Delhi metallo-beta-lactamase-1)이라는 효소는 박테리아가 광범위 베타-락탐계 항생제(beta-lactam antibiotics)에 내성을 갖도록 만듭니다. 항생제내성 박테리아 감염 치료에 사용되는 주된 버팀목인 카바페넴(carbapenem) 계열의 항생제도 이들에 속하며, NDM-1은 카바페넴(carbapenem)을 분해합니다. NDM-1은 2008년 인도계 스웨덴인으로부터 분리된 폐렴간균(Klebsiella pneumonia)에서 처음 검출되었습니다. 폐렴간균(Klebsiella pneumonia)은 폐렴, 혈류감염, 상처나 수술부위감염, 카테터 관련 요로감염 (catheter associated urinarytract infection)을 포함한 여러 다른 형태의 의료시설관련 감염을 일으킬 수 있습니다.
 폐렴간균(Klebsiella pneumonia)은 사람의 장과 배설물에서 정상적으로 발견되며, 질병을 일으키지 않습니다. 폐렴간균(Klebsiella pneumonia) 감염은 병원이나 요양원 같은 의료시설에서 매우 위중한 상태로 치료를 받는 중환자들 중에서 가장 흔히 발생합니다. 항생제들에 내성을 보이는 폐렴간균(Klebsiella pneumonia)은 최근 카바페넴(carbapenem)계 항생제에도 내성을 가지게 되었습니다 (carbapenem-resistant Klebsiella pneumonia, CRKP). 카바페넴 내성 폐렴간균(CRKP)은 거의 모든 선택된 항생제에 저항하므로, 높은 치사율과 장기간의 입원, 고가의 의료비를 야기시키고 있습니다.
폐렴간균(Klebsiella pneumonia)은 사람의 장과 배설물에서 정상적으로 발견되며, 질병을 일으키지 않습니다. 폐렴간균(Klebsiella pneumonia) 감염은 병원이나 요양원 같은 의료시설에서 매우 위중한 상태로 치료를 받는 중환자들 중에서 가장 흔히 발생합니다. 항생제들에 내성을 보이는 폐렴간균(Klebsiella pneumonia)은 최근 카바페넴(carbapenem)계 항생제에도 내성을 가지게 되었습니다 (carbapenem-resistant Klebsiella pneumonia, CRKP). 카바페넴 내성 폐렴간균(CRKP)은 거의 모든 선택된 항생제에 저항하므로, 높은 치사율과 장기간의 입원, 고가의 의료비를 야기시키고 있습니다.
NDM-1은 그 후 인도와 파키스탄, 영국, 미국, 캐나다, 일본, 브라질의 박테리아에서 발견되었습니다. 효소 NDM-1을 만드는 가장 흔한 박테리아는 대장균(Escherichia coli)과 폐렴간균(Klebsiella pneumonia) 같은 그람음성 세균이지만, 그러나 NDM-1 유전자는 한 종류의 박테리아로부터 수평적 유전자이동(horizontal gene transfer)을 통해 다른 균주 또는 종으로 확산될 수 있습니다. 내성요인은 14종의 다른 박테리아로 확산되었으며, 여기에는 이질과 콜레라를 일으키는 다양한 병원성요인들이 포함됩니다. NDM-1 유전자가 들어있는 플라스미드(plasmid)를 지닌 모든 박테리아는 가장 지독하고 부작용이 심한 두 가지 항생제 외에는 모든 항생제에 내성을 보입니다. 또한 한 종류의 박테리아는 모든 항생제에 내성을 보입니다.
 폐렴구균(streptococcus pneumonia)은 전세계적으로 특히 어린이와 노년층에서 감염질환으로 인한 사망의 가장 주된 원인의 하나입니다. 1970년대 말, 스페인과 남아프리카에서 페니실린에 내성을 보이는 폐렴구균 종류가 처음 보고되었습니다. 그 후 페니실린 내성 폐렴구균은 1990년대 초까지 유럽을 거쳐 전세계로 급속히 확산되었습니다. 전세계적인 폐렴구균은 3가지 계열 이상의 항생제에 내성을 보이는 다제내성(multidrug-resistant, MDR)입니다. 가장 무서운 사례로, 미국 뉴욕 로체스터(Rochester)에서 9명의 어린이에게서 어린이용으로 승인된 18가지의 항생제 모두를 무력화시키는 폐렴구균감염이 발생했습니다. 이 박테리아를 발견한 이곳 의사는 존슨앤존슨(Johnson & Johnson) 사의 플루로퀴놀론계(fluroquinolone) 성인용 항생제인 레바퀸(Levaquin)을 투여하여 감염을 퇴치하였지만, 그 후 단지 한 어린이만이 영구적으로 청력을 상실한 채로 살아남았습니다.
폐렴구균(streptococcus pneumonia)은 전세계적으로 특히 어린이와 노년층에서 감염질환으로 인한 사망의 가장 주된 원인의 하나입니다. 1970년대 말, 스페인과 남아프리카에서 페니실린에 내성을 보이는 폐렴구균 종류가 처음 보고되었습니다. 그 후 페니실린 내성 폐렴구균은 1990년대 초까지 유럽을 거쳐 전세계로 급속히 확산되었습니다. 전세계적인 폐렴구균은 3가지 계열 이상의 항생제에 내성을 보이는 다제내성(multidrug-resistant, MDR)입니다. 가장 무서운 사례로, 미국 뉴욕 로체스터(Rochester)에서 9명의 어린이에게서 어린이용으로 승인된 18가지의 항생제 모두를 무력화시키는 폐렴구균감염이 발생했습니다. 이 박테리아를 발견한 이곳 의사는 존슨앤존슨(Johnson & Johnson) 사의 플루로퀴놀론계(fluroquinolone) 성인용 항생제인 레바퀸(Levaquin)을 투여하여 감염을 퇴치하였지만, 그 후 단지 한 어린이만이 영구적으로 청력을 상실한 채로 살아남았습니다.
 임질(Gonorrhea) 의 원인균은 가장 흔한 감염 박테리아(배양이 까다로운 그람음성 쌍구균)으로 인체의 점막, 특히 남성과 여성의 구강과 목구멍, 항문, 그리고 여성의 생식관인 자궁경부와 자궁, 나팔관에서 자라고 빠르게 증식할 수 있습니다. 과학자들은 임질치료에 사용해온 세팔로스포린(cephalosporin)계 항생제에 내성을 보이는 새로운 형태의 임질균을 일본에서 발견했습니다. H041로 불리는 이 슈퍼임균은 만일 과학자들이 이 박테리아의 항생제내성을 제거하는 방법을 찾지 못한다면 전세계적인 증후군으로 나타날 것입니다. 미국 정부의 보건당국은 성적접촉으로 전염되는 질환인 임질이 이를 치료할 수 있는 마지막 남은 종류의 항생제에 대한 내성이 증가하고 있음을 경고했습니다.
임질(Gonorrhea) 의 원인균은 가장 흔한 감염 박테리아(배양이 까다로운 그람음성 쌍구균)으로 인체의 점막, 특히 남성과 여성의 구강과 목구멍, 항문, 그리고 여성의 생식관인 자궁경부와 자궁, 나팔관에서 자라고 빠르게 증식할 수 있습니다. 과학자들은 임질치료에 사용해온 세팔로스포린(cephalosporin)계 항생제에 내성을 보이는 새로운 형태의 임질균을 일본에서 발견했습니다. H041로 불리는 이 슈퍼임균은 만일 과학자들이 이 박테리아의 항생제내성을 제거하는 방법을 찾지 못한다면 전세계적인 증후군으로 나타날 것입니다. 미국 정부의 보건당국은 성적접촉으로 전염되는 질환인 임질이 이를 치료할 수 있는 마지막 남은 종류의 항생제에 대한 내성이 증가하고 있음을 경고했습니다.
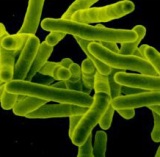 결핵(Tuberculosis,TB)은 마이코박테리움 튜버큐로시스(Mycobacterium tuberculosis)라 불리는 원인균으로 인한 질환으로로, 환자의 재채기나 기침 또는 호흡시 공기를 통해 전염됩니다. 결핵은 다제내성(MDR), 그리고 광범위약제내성 두 가지 형태가 나타나고 있습니다. 다제내성(MDR) 결핵은 최소한 결핵치료에 사용되는 2가지의 주요 약물 이소니아지드(isoniazid)와 리팜핀(rifampin)에 내성을 보입니다.
결핵(Tuberculosis,TB)은 마이코박테리움 튜버큐로시스(Mycobacterium tuberculosis)라 불리는 원인균으로 인한 질환으로로, 환자의 재채기나 기침 또는 호흡시 공기를 통해 전염됩니다. 결핵은 다제내성(MDR), 그리고 광범위약제내성 두 가지 형태가 나타나고 있습니다. 다제내성(MDR) 결핵은 최소한 결핵치료에 사용되는 2가지의 주요 약물 이소니아지드(isoniazid)와 리팜핀(rifampin)에 내성을 보입니다.
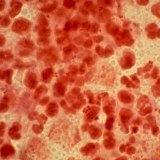 수막구균(Neisseria meningitides)은 수막염(meningitis)을 비롯해 수막구균혈증(meningococcemia) 같은 다른 형태의 수막구균성 질환을 일으키는 박테리아입니다. 수막구균은 선진국에서는 소아 의 질병이환율과 치사율의 주요 원인의 하나며, 아프리카와 아시아에서는 증후군의 원인입니다. 수막염(meningitis)은 뇌와 척수를 덮고있는 막에 염증이 생기는 질환이며, 때로는 척수막염(spinal meningitis)으로도 언급됩니다. 수막염(meningitis)은 대개 바이러스 또는 박테리아에 감염되는 것이 원인입니다. 수막염은 감염원에 따라 증세의 심각성과 치료법이 달라지므로 둘 중 어느 것인지를 확인하는 것은 대단히 중요합니다. 바이러스성 수막염은 일반적으로 증세가 덜 심하고 특별한 치료 없이도 회복됩니다. 그러나 박테리아성 수막염은 증세가 매우 심하며, 항생제로 치료한다고 해도 뇌손상, 청력손실 또는 정신지체가 올 수 있습니다. 수막구균 역시 페니실린에 대항하는 내성이 증가한다는 것이 보고되고 있습니다.
수막구균(Neisseria meningitides)은 수막염(meningitis)을 비롯해 수막구균혈증(meningococcemia) 같은 다른 형태의 수막구균성 질환을 일으키는 박테리아입니다. 수막구균은 선진국에서는 소아 의 질병이환율과 치사율의 주요 원인의 하나며, 아프리카와 아시아에서는 증후군의 원인입니다. 수막염(meningitis)은 뇌와 척수를 덮고있는 막에 염증이 생기는 질환이며, 때로는 척수막염(spinal meningitis)으로도 언급됩니다. 수막염(meningitis)은 대개 바이러스 또는 박테리아에 감염되는 것이 원인입니다. 수막염은 감염원에 따라 증세의 심각성과 치료법이 달라지므로 둘 중 어느 것인지를 확인하는 것은 대단히 중요합니다. 바이러스성 수막염은 일반적으로 증세가 덜 심하고 특별한 치료 없이도 회복됩니다. 그러나 박테리아성 수막염은 증세가 매우 심하며, 항생제로 치료한다고 해도 뇌손상, 청력손실 또는 정신지체가 올 수 있습니다. 수막구균 역시 페니실린에 대항하는 내성이 증가한다는 것이 보고되고 있습니다.
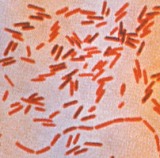 장티푸스(Typhoid fever)는 살모넬라균의 일종인 박테리아(Salmonella Typhi)가 일으키는 치명적인 급성 전신감염질환이며, 장티푸스 치료에 우선적으로 사용되는 플루오로퀴놀론(fluoroquinolone) 계 항생제에 대해 저하된 감수성을 지닌 다제내성(MDR)이 자주 나타나고 있습니다. 장티푸스 균(S. Typhi)은 수천년간 사람에게 질병을 일으키는 주요 병원균으로 위생상태가 나쁘고 사람이 많이 모이는 장소, 그리고 사회적으로 혼란한 여건에서 번성합니다. 장티푸스는 적절히 치료되지 않으면 의식장애(delirium), 둔감상태(obtundation), 장출혈( intestinal hemorrhage), 장천공(Intestinal perforation)이 일어나고 발병 후1개월 내에 사망할 수 있는 무서운 질환입니다. 생존자들도 장기간 또는 영구적인 신경정신과적 합병증 상태로 남을 수 있습니다.
장티푸스(Typhoid fever)는 살모넬라균의 일종인 박테리아(Salmonella Typhi)가 일으키는 치명적인 급성 전신감염질환이며, 장티푸스 치료에 우선적으로 사용되는 플루오로퀴놀론(fluoroquinolone) 계 항생제에 대해 저하된 감수성을 지닌 다제내성(MDR)이 자주 나타나고 있습니다. 장티푸스 균(S. Typhi)은 수천년간 사람에게 질병을 일으키는 주요 병원균으로 위생상태가 나쁘고 사람이 많이 모이는 장소, 그리고 사회적으로 혼란한 여건에서 번성합니다. 장티푸스는 적절히 치료되지 않으면 의식장애(delirium), 둔감상태(obtundation), 장출혈( intestinal hemorrhage), 장천공(Intestinal perforation)이 일어나고 발병 후1개월 내에 사망할 수 있는 무서운 질환입니다. 생존자들도 장기간 또는 영구적인 신경정신과적 합병증 상태로 남을 수 있습니다.
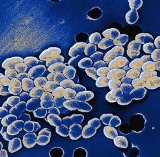 장구균(Enterococci)은 그람양성 통성 혐기성 박테리아로 건강한 사람 매 20명당 19명의 위와 장에서 발견됩니다. 장구균은 열린상처와 피부궤양으로 들어와 감염을 일으킬 수 있으며, 드물게는 혈액이나 다른 신체조직에 더욱 심각한 감염을 일으킬 수도 있습니다. 반코마이신 내성 장구균(Vancomycin-Resistant Enterococci, VRE)은 장구균감염치료에 사용되는 항생제 반코마이신 (vancomycin)에 내성을 지닌 박테리아입니다. 다른 항생제들은 장구균감염 치료에 별로 효과가 없습니다. 그러므로, 심각한 VRE감염인 경우에는 이들이 반코마이신에 내성을 가지므로 치료가 대단히 어려워질 것입니다.
장구균(Enterococci)은 그람양성 통성 혐기성 박테리아로 건강한 사람 매 20명당 19명의 위와 장에서 발견됩니다. 장구균은 열린상처와 피부궤양으로 들어와 감염을 일으킬 수 있으며, 드물게는 혈액이나 다른 신체조직에 더욱 심각한 감염을 일으킬 수도 있습니다. 반코마이신 내성 장구균(Vancomycin-Resistant Enterococci, VRE)은 장구균감염치료에 사용되는 항생제 반코마이신 (vancomycin)에 내성을 지닌 박테리아입니다. 다른 항생제들은 장구균감염 치료에 별로 효과가 없습니다. 그러므로, 심각한 VRE감염인 경우에는 이들이 반코마이신에 내성을 가지므로 치료가 대단히 어려워질 것입니다.
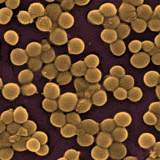 황색포도상구균(Staphylococcus aureus)은 약 30% 정도의 사람들의 피부와 코에서 흔히 발견되는 박테리아입니다. 전형적으로 이들 황색포도상구균은 해롭지 않습니다. 황색포도상구균 감염증은 여드름이나 뾰로지 또는 피부에 무엇이 생긴 것처럼 보이며 대부분 치료가능합니다. 그러나 때로는 이 박테리아가 혈류로 들어갈 수 있으며, 치명적일 수도 있는 심각한 감염질환을 일으키기도 합니다. 반코마이신 중등도내성 황색포도상구균(VISA)과 반코마이신 내성 황색포도상구균(VRSA)은 항생제에 대한 감수성이 떨어지고 내성을 지닌 특정 종류의 박테리아입니다.
황색포도상구균(Staphylococcus aureus)은 약 30% 정도의 사람들의 피부와 코에서 흔히 발견되는 박테리아입니다. 전형적으로 이들 황색포도상구균은 해롭지 않습니다. 황색포도상구균 감염증은 여드름이나 뾰로지 또는 피부에 무엇이 생긴 것처럼 보이며 대부분 치료가능합니다. 그러나 때로는 이 박테리아가 혈류로 들어갈 수 있으며, 치명적일 수도 있는 심각한 감염질환을 일으키기도 합니다. 반코마이신 중등도내성 황색포도상구균(VISA)과 반코마이신 내성 황색포도상구균(VRSA)은 항생제에 대한 감수성이 떨어지고 내성을 지닌 특정 종류의 박테리아입니다.
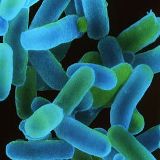 시겔라(Shigella)는 세균성 이질로 알려진 설사병을 일으키는 박테리아입니다. 시겔라(Shigella)는 100마리 미만의 적은 양이 몸에 들어와도 세균성 설사를 일으킬 수 있고 가장 전염이 잘되는 설사 원인균의 하나입니다. 시겔라(Shigella)는 주로 배설물-경구의 경로를 통해 감염될 수 있습니다. 사람이나 동물의 배설물에 오염된 음식물을 통해 전염되므로, 유아용 기저귀를 다루거나 오염된 상수원 또는 하수에 오염된 밭에서 자란 채소를 먹는 것도 세균성 설사를 일으킬 수 있는 행위입니다. 후진국에서는 전통적으로 세균성 설사를 위험하게 여기지 않습니다. 설사병을 앓는 기간을 줄이고 다른 사람에게 감염되는 것을 줄이기 위해 전통적으로 코트리목사졸(cotrmoxazole) 또는 암피실린(ampicillin) 같은 항생제를 주로 처방합니다. 그러나 수십년이 지나며 시겔라(Shigella)는 다중의 항생제에 내성을 나타내므로, 임상적 경험을 통한 약물선택에 어려움을 겪고 있습니다.
시겔라(Shigella)는 세균성 이질로 알려진 설사병을 일으키는 박테리아입니다. 시겔라(Shigella)는 100마리 미만의 적은 양이 몸에 들어와도 세균성 설사를 일으킬 수 있고 가장 전염이 잘되는 설사 원인균의 하나입니다. 시겔라(Shigella)는 주로 배설물-경구의 경로를 통해 감염될 수 있습니다. 사람이나 동물의 배설물에 오염된 음식물을 통해 전염되므로, 유아용 기저귀를 다루거나 오염된 상수원 또는 하수에 오염된 밭에서 자란 채소를 먹는 것도 세균성 설사를 일으킬 수 있는 행위입니다. 후진국에서는 전통적으로 세균성 설사를 위험하게 여기지 않습니다. 설사병을 앓는 기간을 줄이고 다른 사람에게 감염되는 것을 줄이기 위해 전통적으로 코트리목사졸(cotrmoxazole) 또는 암피실린(ampicillin) 같은 항생제를 주로 처방합니다. 그러나 수십년이 지나며 시겔라(Shigella)는 다중의 항생제에 내성을 나타내므로, 임상적 경험을 통한 약물선택에 어려움을 겪고 있습니다.
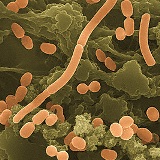 아시네토박터(acinetobacter) 박테리아는 물과 토양, 하수에 존재합니다. 아시네토박터(acinetobacter)는 면역력이 약화된 병원의 환자들에게 심각한 혈류감염과 폐렴을 일으키는 원인균입니다. 아시네토박터(acinetobacter) 감염은 드물지만, 그러나 일단 발생하면 대개 수분함량이 많은 신체기관계통(예, 호흡기의 기도, 뇌척수액, 복막액, 요도 등)이 관련되며, 입원중 걸리는 원내폐렴, 말기 신부전증 환자의 지속성 외래 복막투석(continuous ambulatory peritoneal dialysis, CAPD)과 관련된 감염 또는 요도에 투입하는 카테터(catheter) 관련 요로감염으로 나타납니다. 다제내성(MDR) 아시네토박터(acinetobacter)는 새롭게 대두되는 현상이 아니라, 이미 1970년대 이후 병원에 입원한 중환자들 사이에서 퍼지고 유행되어 심각한 걱정거리로 대두되고 있습니다.
아시네토박터(acinetobacter) 박테리아는 물과 토양, 하수에 존재합니다. 아시네토박터(acinetobacter)는 면역력이 약화된 병원의 환자들에게 심각한 혈류감염과 폐렴을 일으키는 원인균입니다. 아시네토박터(acinetobacter) 감염은 드물지만, 그러나 일단 발생하면 대개 수분함량이 많은 신체기관계통(예, 호흡기의 기도, 뇌척수액, 복막액, 요도 등)이 관련되며, 입원중 걸리는 원내폐렴, 말기 신부전증 환자의 지속성 외래 복막투석(continuous ambulatory peritoneal dialysis, CAPD)과 관련된 감염 또는 요도에 투입하는 카테터(catheter) 관련 요로감염으로 나타납니다. 다제내성(MDR) 아시네토박터(acinetobacter)는 새롭게 대두되는 현상이 아니라, 이미 1970년대 이후 병원에 입원한 중환자들 사이에서 퍼지고 유행되어 심각한 걱정거리로 대두되고 있습니다.
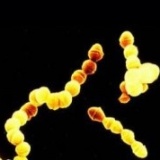 B그룹 연쇄상구균(Group B Streptococcus, GBS)은 위장관에서 흔히 발견되며, 남녀 모두의 요도에 보유하고 있지만 감염증상을 일으키지 않으므로 해롭지 않습니다. GBS는 또한 상부호흡기에도 보유할 수 있습니다. 그러나 GBS는 신생아의 경우 생명을 위협하는 심각한 감염증상(폐렴, 폐혈증, 수막염)의 주요 원인입니다. 신생아에서 GBS 패혈증으로 인한 사망율은 50%가 넘으며, 특히 조산아에서 사망율이 높습니다. 건강한 여성의 15%-45%는 질 및 위장관에 GBS를 보유하고 있습니다. 신생아는 GBS에 대한 항체가 없다는 것이 감염의 위험요인입니다. 70세 이상의 노인들에서 GBS감염은 울혈성심부전 및 침대에 누워서만 지내는 것과 깊이 연관되었으며, 가장 일반적인 감염증상으로 나타나는 것이 요로감염이나 폐렴, 그리고 연조직감염(soft-tissue infection) 입니다. GBS를 보유한 여성으로 페니실린에 심한 알러지가 있는 경우에는 에리스로마이신(erythromycin)과 클린다마이신(clindamycin)이 최적의 약입니다. 그러나 에리스로마이신(erythromycin)과 클린다마이신(clindamycin)에 내성을 지닌 GBS의 이환율이 높습니다.
B그룹 연쇄상구균(Group B Streptococcus, GBS)은 위장관에서 흔히 발견되며, 남녀 모두의 요도에 보유하고 있지만 감염증상을 일으키지 않으므로 해롭지 않습니다. GBS는 또한 상부호흡기에도 보유할 수 있습니다. 그러나 GBS는 신생아의 경우 생명을 위협하는 심각한 감염증상(폐렴, 폐혈증, 수막염)의 주요 원인입니다. 신생아에서 GBS 패혈증으로 인한 사망율은 50%가 넘으며, 특히 조산아에서 사망율이 높습니다. 건강한 여성의 15%-45%는 질 및 위장관에 GBS를 보유하고 있습니다. 신생아는 GBS에 대한 항체가 없다는 것이 감염의 위험요인입니다. 70세 이상의 노인들에서 GBS감염은 울혈성심부전 및 침대에 누워서만 지내는 것과 깊이 연관되었으며, 가장 일반적인 감염증상으로 나타나는 것이 요로감염이나 폐렴, 그리고 연조직감염(soft-tissue infection) 입니다. GBS를 보유한 여성으로 페니실린에 심한 알러지가 있는 경우에는 에리스로마이신(erythromycin)과 클린다마이신(clindamycin)이 최적의 약입니다. 그러나 에리스로마이신(erythromycin)과 클린다마이신(clindamycin)에 내성을 지닌 GBS의 이환율이 높습니다.
다제내성(MDR) 슈퍼 박테리아를 퇴치할 수 있는 최상의 방법은 무엇인가?
우리는 “박테리아” 란 단어를 읽거나 들으면 병에 걸리는 것을 우선 떠올리지만, 그러나 모든 박테리아가 해로운 것은 아닙니다. 어떤 박테리아들은 사람에게 매우 유익합니다. 박테리아는 의약품과 식품, 연료의 생산에 관련되었으며, 또한 환경재생과 정화에도 이용됩니다. 사실 어떤 박테리들이 없다면 사람의 삶이 훨씬 더 괴로워질 것입니다. 인체도 유익한 박테리아로 채워져 있습니다. 사람의 소화관은 유익한 박테리아들이 채워져 있으며, 이들은 다른 해로운 박테리아의 번식을 미리 막아내고, 음식물의 소화를 돕는 인체에 필수적인 두 가지 목표를 수행합니다. 이들 박테리아는 인체의 화학물질들과 함께 작용하여 음식물을 분해하고, 이를 유용한 비타민과 미네랄로 전환시키며, 영양소들이 장 벽을 통과, 흡수되어 혈액을 따라 순환될 수 있도록 만들어 줍니다. 사람의 피부에도 많은 종류의 해롭지 않은 박테리아들이 있습니다. 이들은 해로운 박테리아가 피부에 자리잡지 못하도록 차단합니다. 사실은 인체에 이런 유익한 박테리아가 없다면, 병이 생길 것입니다. 불행하게도 대부분의 사람들은 모든 박테리아를 없애려 듭니다. 명심하시기 바랍니다. 불필요한 항생제 사용은 피해야 합니다.
분명히 현대의학은 치료에 중요한 위치를 점하고 있습니다. 헌신적이고 똑똑한 대부분 의사들이 훌륭하게 치료를 하지만, 그러나 때로는 이들 치료가 희망이 없거나, 또는 상태를 더욱 악화시킬 수도 있습니다. 만일 우리가 다제내성(MDR) 슈퍼 박테리아에 감염이 되었다면, 치료를 위해 할 수 있는게 무엇이 있겠습니까? 첫째, 두려워하지 말아야 합니다. 우리의 몸은 세균과의 전쟁에서 우리를 위해 훌륭하게 전투임무를 수행하도록 설계되었습니다. 우리는 이들 감염을 치료할 어떠한 대체방안이 필요합니다. 우리는 질병이 아니라 인체의 생리적 구조와 특성에 주의를 기울일 필요가 있습니다.
 항생제는 정상적인 면역계의 세포기능 수행과정을 약화시키고, 근본적인 문제를 해결하지 못합니다. 인체는 전통적인 항생제를 사용하지 않고서도 다제내성(MDR) 슈퍼 박테리아의 확산을 막는 것이 가능합니다. 독성이나 부작용이 없는 천연성분을 사용하여 면역계의 증진, 균형, 강화를 돕고, 최상의 생체방어기전인 면역계를 확립하는 것은 가능한 일입니다. 면역계는 인체를 감염과 외부 항원으로 부터 보호하는 역할을 하는 면역세포와 면역물질, 면역유전자가 상호 연결된 대단히 다양한 복합체입니다. 따라서 건강한 면역계는 슈퍼 박테리아의 침투를 물리칠 수 있습니다. 특정 영양성분들과 면역조절물질, 생체요소들은 면역계의 세포기능 수행과정을 돕고 면역계의 기능장애를 바로 잡아줍니다. 핵심 면역계의 건강은 구강에서 부터 시작해서 전신에 걸쳐 진행되는 연쇄적 면역반응을 돕고, 외부항원을 찾아내어 파괴시키는 면역세포인 NK세포, B세포, T세포의 반응을 최적화시킵니다. 그러므로 인체는 면역기능을 극대화시킬 수 있으며, 슈퍼 박테리아를 퇴치시킬 수 있습니다. 헤파짐(Hepazym)을 사용하는 면역요법(immunotherapy)은 다제내성(MDR) 슈퍼 박테리아와의 전투에서 아마도 최상의 무기가 될 수 있을 것이며, 환자의 생명을 구할 수도 있을 것입니다. 헤파짐(Hepazym)은 항생제들보다 훨씬 더 특수한 효과가 있으므로, 인체 뿐만이 아니라 장내 세균총(gut flora) 같은 다른 유익한 박테리아들에도 해가 되지 않는 치료제로 적용될 수가 있으며, 기회감염(면역체계가 정상적으로 작동하지 않을 때 발생하는 감염)을 줄여줍니다. 헤파짐(Hepazym) 면역요법은 약물과는 정반대로 어떠한 원하지 않는 부작용을 일으키지 않고, 또한 간에 부담을 주지 않고 보호하므로, 높은 치료지수(therapeutic index)를 나타낼 것이며, 단지 해로운 박테리아만을 죽일 것입니다. 헤파짐(Hepazym) 면역요법은 현재 전통적인 항생제에 반응하지 않는 슈퍼 박테리아 감염 환자분들의 치료에 적용되고 있으며, 항생제보다 훨씬 더 성공적인 결과를 보입니다.
항생제는 정상적인 면역계의 세포기능 수행과정을 약화시키고, 근본적인 문제를 해결하지 못합니다. 인체는 전통적인 항생제를 사용하지 않고서도 다제내성(MDR) 슈퍼 박테리아의 확산을 막는 것이 가능합니다. 독성이나 부작용이 없는 천연성분을 사용하여 면역계의 증진, 균형, 강화를 돕고, 최상의 생체방어기전인 면역계를 확립하는 것은 가능한 일입니다. 면역계는 인체를 감염과 외부 항원으로 부터 보호하는 역할을 하는 면역세포와 면역물질, 면역유전자가 상호 연결된 대단히 다양한 복합체입니다. 따라서 건강한 면역계는 슈퍼 박테리아의 침투를 물리칠 수 있습니다. 특정 영양성분들과 면역조절물질, 생체요소들은 면역계의 세포기능 수행과정을 돕고 면역계의 기능장애를 바로 잡아줍니다. 핵심 면역계의 건강은 구강에서 부터 시작해서 전신에 걸쳐 진행되는 연쇄적 면역반응을 돕고, 외부항원을 찾아내어 파괴시키는 면역세포인 NK세포, B세포, T세포의 반응을 최적화시킵니다. 그러므로 인체는 면역기능을 극대화시킬 수 있으며, 슈퍼 박테리아를 퇴치시킬 수 있습니다. 헤파짐(Hepazym)을 사용하는 면역요법(immunotherapy)은 다제내성(MDR) 슈퍼 박테리아와의 전투에서 아마도 최상의 무기가 될 수 있을 것이며, 환자의 생명을 구할 수도 있을 것입니다. 헤파짐(Hepazym)은 항생제들보다 훨씬 더 특수한 효과가 있으므로, 인체 뿐만이 아니라 장내 세균총(gut flora) 같은 다른 유익한 박테리아들에도 해가 되지 않는 치료제로 적용될 수가 있으며, 기회감염(면역체계가 정상적으로 작동하지 않을 때 발생하는 감염)을 줄여줍니다. 헤파짐(Hepazym) 면역요법은 약물과는 정반대로 어떠한 원하지 않는 부작용을 일으키지 않고, 또한 간에 부담을 주지 않고 보호하므로, 높은 치료지수(therapeutic index)를 나타낼 것이며, 단지 해로운 박테리아만을 죽일 것입니다. 헤파짐(Hepazym) 면역요법은 현재 전통적인 항생제에 반응하지 않는 슈퍼 박테리아 감염 환자분들의 치료에 적용되고 있으며, 항생제보다 훨씬 더 성공적인 결과를 보입니다.